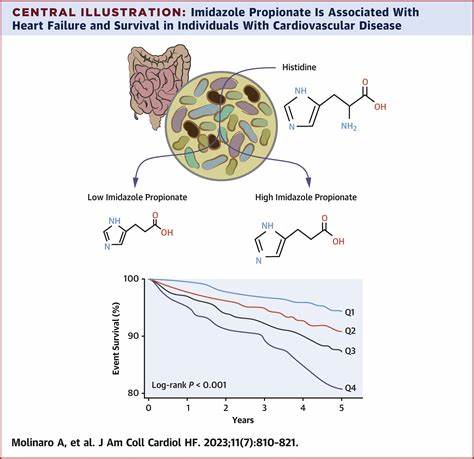
动脉粥样硬化是全球范围内导致心血管疾病的主要病理基础,其复杂的发病机制一直是医学研究的重点。传统上,动脉粥样硬化的预防侧重于控制已知风险因素,如高血脂、高血压和吸烟等。然而,越来越多的研究发现,许多患者尽管经过了严格的风险因素管理,依然存在严重的残余心血管风险,提示我们对病理机制的理解尚不充分。近期一项划时代的研究揭示了组胺丙酸(Imidazole Propionate,简称ImP)这一肠道微生物代谢产物与动脉粥样硬化之间的紧密联系,为我们认识动脉粥样硬化开辟了全新的视角。组胺丙酸到底是什么?它如何驱动动脉粥样硬化?又为何成为潜力巨大的治疗靶点?带着这些问题,我们全面解析最新的科学发现,揭示ImP在心血管健康中的独特作用。组胺丙酸是由肠道微生物对组氨酸这一氨基酸进行代谢产生的一种小分子物质。
它的出现体现了宿主与肠道菌群代谢互动的复杂性。通过动物模型研究发现,组胺丙酸的血浆水平与动脉粥样硬化程度密切相关。特别是在动脉粥样硬化易感的Apoe缺失小鼠中,给予组胺丙酸补充的动物展现出显著的病变进展,且这一过程与传统脂质指标水平无关,挑战了以血脂调控为核心的现有病理认知。临床研究进一步证实了这一结论。在两个人体独立队列中,组胺丙酸的血浆浓度与早期亚临床动脉粥样硬化呈正相关,这种相关性独立于糖尿病、高血压及传统炎症指标。借助先进的多模态血管影像技术,研究人员还能细化动脉内的炎症活动状态,发现组胺丙酸的升高尤为显著地与活跃病变相关。
换句话说,组胺丙酸不单是疾病进展的标志,更有望成为早期发现动脉粥样硬化的生物标志物。更为引人注目的是,组胺丙酸促发动脉粥样硬化的机制指向一种名为imidazoline-1受体(I1R,亦称Nischarin)的信号通路。研究表明,ImP在免疫细胞,尤其是髓系细胞中,通过激活I1R,增强mTOR信号通路活性,诱导炎症介质的产生,激活免疫细胞的促炎应答。这不仅导致血管局部炎症加剧,也促进了免疫细胞的浸润和斑块形成。该发现揭示了微生物代谢物与免疫调控交汇的重要节点,突显了肠道菌群代谢在动脉粥样硬化中的核心作用。以I1R为目标的治疗策略显示出极大前景。
在小鼠模型中,使用选择性I1R拮抗剂AGN192403能够显著减缓或逆转组胺丙酸介导的动脉粥样硬化进展,降低局部炎症水平和斑块不稳定性标志。这种效果并非通过调节胆固醇实现,而是依赖于免疫和炎症路径的调控,开创了动脉粥样硬化治疗的新思路。了解ImP与肠道微生物组的关系也极为关键。研究证明,高胆固醇饮食可促使肠道中特定菌群,如大肠杆菌属和志贺氏菌属等丰富,进而增加组胺丙酸的生成。不同的饮食模式,尤其是地中海饮食,能够降低组胺丙酸水平并缓解炎症反应,暗示饮食调节作为控制ImP水平及其临床影响的有效路径。此外,体内ImP水平与肥胖、胰岛素抵抗和慢性炎症指标相关联,说明它在整体心血管代谢健康中的作用可能远超预期。
展望未来,组胺丙酸及其调控通路将成为心血管疾病早期筛查和个性化治疗的关键。基于血浆ImP浓度的检测方法的开发,有望帮助识别风险较高的早期无症状患者,实施精准干预。同时,针对ImP–I1R信号轴的药物研发,有潜力补充现有的脂质调控治疗,为难治性动脉粥样硬化患者提供新的选择。不容忽视的是,ImP研究也丰富了我们对肠道菌群与宿主免疫-代谢交互影响的整体认识。它彰显了微生态代谢物在系统性疾病发病机制中的桥梁作用,推动了肠道菌群相关治疗方案的开拓。总之,组胺丙酸作为一个新兴微生物代谢物,不仅揭示了动脉粥样硬化发病的核心机制之一,更标志着未来心血管疾病诊疗模式的重大转变。
围绕其作用机制及治疗潜能的持续探索,将为减轻全球范围心血管疾病负担做出重要贡献。