疟疾作为全球最严重的传染病之一,每年导致数十万人死亡,尤其是发展中国家的公共卫生威胁尤为突出。尽管蚊帐、杀虫剂和抗疟药物等传统手段在过去十年内带来了疟疾发病率的显著下降,但随着蚊虫对杀虫剂的抗药性增强及疟原虫对药物的耐药性出现,这些控制措施面临严峻挑战。为此,科学界亟需开发全新的策略对抗疟疾,特别是在病媒控制领域的创新基因技术成为研究热点。近期,驱动蚊子FREP1基因中一种天然存在的保护性等位基因的研究取得了突破性进展,有望为疟疾根除提供革命性工具。 FREP1(纤维蛋白原相关蛋白1)是疟疾传播过程中蚊虫中枢纽角色的分子,主要功能是介导疟原虫穿越蚊子肠道上皮的重要环节。研究发现,FREP1蛋白的特定等位基因Q224能够显著抑制寄生虫的感染和传播,而该异构体不仅不影响蚊虫的基本生理功能,还大幅降低了疟疾寄生虫在蚊虫内的发育速度,减弱其传染能力。
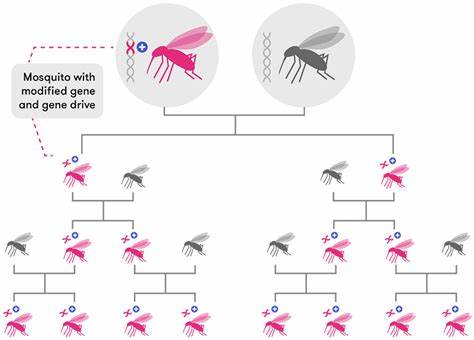
针对这一发现,科学家们利用基因编辑技术在亚洲主疟媒蚊Anopheles stephensi中精准打造了FREP1基因保护性Q224等位基因的同源系蚊群,通过CRISPR-Cas9系统插入带有选择性荧光标记的编辑元件,实现了对蚊群的稳定遗传改造。这些改造后的蚊子在实验室条件下展示了对人类疟疾原虫Plasmodium falciparum和鼠疟疾原虫Plasmodium berghei的高度抗性,表现为寄生虫发育前期阶段的显著抑制,最终导致唾液腺中寄生虫数量的大幅减少,极大降低了传播风险。 在蚊虫的生长发育、生育能力和寿命等生物学指标方面,携带FREP1Q224等位基因的蚊群基本与对照组无显著差异,显示该基因编辑几乎不造成蚊虫的适应性负担,这一点对于将来可能的野外应用至关重要。为了实现该保护性等位基因在野生蚊群中的扩散,研究团队开发了一种创新的连锁等位基因驱动系统。该系统将驱动元件与目标等位基因紧密连锁,通过靶向破坏感染敏感的FREP1L224等位基因并利用同源重组将其替换为FREP1Q224,实现对野生蚊群中敏感基因型的快速遗传替换。 这种等位基因驱动通过多代蚊群实验验证,展示了显著的超级孟德尔遗传传递规律,使保护性FREP1Q224等位基因的频率迅速提升至90%以上。
驱动过程中伴随着少量非同源末端连接引起的敲除突变,这些突变因导致蚊虫功能丧失,导致较强的自然选择压力而被逐步淘汰。数学模型进一步支持了这一驱动策略的有效性,认为充分的等位基因转换率、相关的适应性优势以及目标基因座上替换的高效性,共同促成了保护性等位基因的成功固定。 这一基因驱动系统不仅成功实现了FREP1基因等位基因的遗传替换,还在实验室规模的蚊群中表现出稳定的长期传播趋势,且不显著降低蚊虫的生存能力和繁殖效果,为将来在自然生态环境中推广提供了坚实基础。未来通过精细调控驱动元件的位置和表达,可以针对不同蚊虫种群及其遗传背景灵活调整,达到既保护环境又高效控制疟疾传播的目标。 驱动保护性FREP1等位基因的策略拥有广泛的应用前景。不仅适用于亚洲疟媒Anopheles stephensi,还可扩展至非洲的主要疟媒蚊Anopheles gambiae。
更重要的是,该等位基因的天然存在性及对蚊子生理无显著副作用特点,有望大幅提高策略的安全性和生态兼容性。同时,该技术为其他病媒昆虫的遗传定向修饰树立了范例,有潜力为控制登革热、寨卡病毒等其他虫媒疾病提供借鉴。 然而,技术在向实际应用转化过程中仍面临挑战。包括驱动系统在复杂自然环境中的传播效率,可能的基因流动及突变逃逸机制,生态安全和伦理法律审查等,都需要科学界、监管机构及公众展开深度对话和严格评估。此外,围绕基因驱动技术的环境影响监测体系也需同步建立,确保生物多样性的保护及潜在负面影响的及时响应。 综上所述,通过基因编辑和超级遗传驱动技术,将FREP1基因中天然存在的保护性等位基因高效传递到疟疾媒介蚊群中,已成为抗击疟疾传播的前沿突破。
它不仅赋予蚊群对疟疾寄生虫的强大抵抗力,还在充分保障蚊虫生态功能和生命力的基础上确保了基因改造的稳定性和持久性。这一创新策略有望借助基因工程为全球疟疾防控注入新动力,推动世卫组织提出的2030年疟疾消除目标的实现,造福受疟疾威胁的数以亿计人群。未来的研究与应用将进一步优化该系统的安全性和有效性,为人类赢得与疟疾抗争的决定性胜利揭开新篇章。