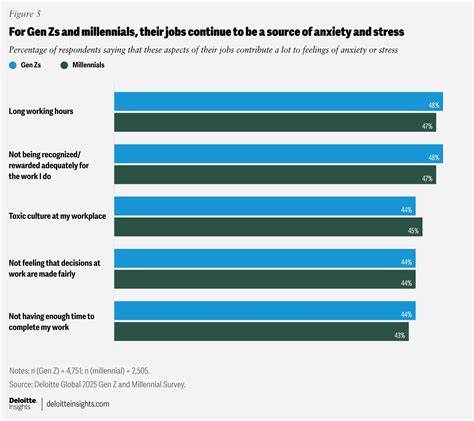
近年来,全球寿命增长的势头出现放缓,科学界对"人类寿命是否已达极限"的讨论愈发热烈。在这一背景下,西班牙Josep Carreras白血病研究所对迄今记录寿命最长的个体 - - 加泰罗尼亚女性玛丽亚·布拉尼亚斯进行的多组学(multi-omics)深入研究,为理解极端长寿提供了宝贵且独特的视角。这项发表在Cell Reports Medicine的研究不仅将衰老过程与疾病区分开来,还揭示了"衰老信号"与"健康长寿信号"并存的复杂性,拓展了我们对延缓衰老与预防老年疾病的认知边界。研究通过最小侵入性的取样手段,整合基因组学、蛋白质组学、表观基因组学、代谢组学与肠道微生物组学,构建了个体化的多层生物学蓝图。研究团队发现,达到超高寿命并非简单由整体延缓衰老机制驱动,而是呈现出一种"悖论式的双重性"。在典型的衰老标志方面,样本显示出端粒明显缩短、免疫系统呈现炎症倾向以及B淋巴细胞群体的老化等特征,这些都是生物学上老化不可忽视的痕迹。
然而,与之并存的是一系列与神经保护、心血管保护相关的遗传特征,系统性的炎症水平低,肠道微生物群中双歧杆菌占优势,以及通过表观遗传学计算的生物年龄明显低于实际年龄。这一发现具有多重意义。首先,它挑战了"长寿等同于普遍延缓衰老"的传统观念,提示我们在研究长寿个体时应关注不同生物系统间的异质性与权衡关系。某些组织或细胞类型可能表现出加速的老化,而整体机体通过遗传背景、代谢调节或微生物共生等机制在关键系统保持功能,从而实现长期健康存活。其次,研究把目光聚焦到血液系统的老化及其与血液恶性疾病之间的联系。血液系统的衰老已被证实与白血病、骨髓增生异常综合征等不可治愈的血液疾病发病率上升密切相关。
理解为何超高寿命个体在拥有老化的血液细胞特征同时并未发展为致命性血液病,可能为血液学疾病的早期识别与预防提供新线索。表观遗传学所揭示的"生物年龄低于实际年龄"是另一项令人瞩目的发现。表观遗传时钟通过DNA甲基化等标记估算细胞或组织的生物学年龄,能够反映累积性环境暴露、代谢状态与疾病风险。目前已有研究表明,部分抗癌药物与表观遗传调控剂能够逆转或调节这些表观标记,在肿瘤学领域已开始应用于治疗策略。将类似概念扩展至延缓衰老或清除衰老细胞(senolytics)方面,可能在未来成为推动寿命上限的一条可行路径,但仍需谨慎评估其长期安全性与系统性影响。肠道微生物群在维护健康中的作用再次被验证。
在玛丽亚·布拉尼亚斯的微生物组中,益生类群如双歧杆菌占优,这与低系统性炎症、良好的代谢稳态以及强化的免疫调节能力相关联。越来越多的证据表明,肠道菌群通过代谢产物、免疫教育以及对神经系统的双向影响,参与衰老过程的调控。因此,肠道微生态作为干预点,对延缓功能衰退和降低慢性病风险具有吸引力。需要强调的是,微生物组的构成既受遗传影响,也深受饮食、生活方式、用药史与社交环境等外部因素塑造,所以可干预性较强也带来了可塑性与个体差异的双重挑战。生活方式因素在研究中被反复提及但未被简单归因。研究团队指出,健康饮食、丰富的社会刺激与社交网络、没有有害嗜好等可能是促成其长寿的环境因素之一,但当前证据尚不足以建立因果关系。
科学与公共卫生实践需要更大规模的纵向研究来分辨基因与环境之间的复杂相互作用以及相对权重。与此同时,这项个案研究的价值在于为未来实验设计提供了具体的生物学靶点和假设检验的起点。从临床与科研的转化视角出发,这份多组学蓝图对血液疾病领域有直接启示。血液系统老化与克隆性造血增生等早期改变可能成为监测与早期干预的关键指标。如果未来研究能辨识出可预测病程进展的表观或分子标志,那么在白血病等疾病发生前采取干预将更具可能性。此外,现有的表观遗传疗法与清除衰老细胞的药物在肿瘤学的成功经验提示了将这些策略用于延缓器官老化与维持组织功能的潜力。
但在推进翻译研究时需权衡短期获益与长期风险,特别是当干预目标涉及免疫系统或基因表达调控时,可能带来未预见的副作用。伦理与社会层面的讨论同样不能忽视。若未来出现能够显著延长健康寿命的干预手段,社会资源分配、医疗公平与人口结构变化等问题将被放大。如何在促进科学发展的同时保证公平可及,避免加剧健康不平等,是科研机构、政策制定者与公众需要共同面对的议题。对超高寿命个体的研究也涉及隐私保护、知情同意与样本使用的伦理规范,必须建立透明与尊重的合作机制。技术层面上,多组学联合分析展现了其强大的洞察力。
通过整合基因组、蛋白质组、表观遗传组、代谢组与微生物组数据,研究人员得以在多尺度上解析生物网络的协同或对立关系。未来结合更大样本量、纵向随访与功能性干预试验,将有助于从相关性走向因果性验证。此外,人工智能与计算诊断在数据整合、模式识别与预测建模方面发挥着越来越重要的作用。Josep Carreras研究所建立的计算诊断中心就是在这种背景下,旨在将AI驱动的方法与生物学专长结合,推动疾病理解与治疗策略的优化。展望未来,研究给出的若干方向值得关注。首先,扩大超高龄与对照人群的多组学样本库,进行跨人群、跨地域的比较分析,以找出普遍性与特异性的长寿标志。
其次,开展纵向研究来追踪表观遗传时钟、免疫谱系与微生物组随时间的动态变化,明确哪些改变是因果性驱动,哪些为随伴现象。再次,基于发现的保护性遗传或分子机制,设计安全的干预试验,例如针对炎症通路的调节、微生物组定向干预或表观遗传调控策略,在严格伦理与安全监管下评估其延缓衰老或降低疾病风险的效果。总之,玛丽亚·布拉尼亚斯个案的多组学研究为理解极端长寿提供了首个全面且系统的生物学蓝图。研究强调了衰老并非单一路径的线性过程,而是各种生物学力量相互博弈的结果。在迈向延长健康寿命的道路上,科学社区需要在分子机制、临床转化与社会伦理之间找到平衡。借助多组学与人工智能等工具,未来有望将这些基础发现转化为可操作的干预策略,为抗击与应对衰老相关疾病提供新的武器,同时促成一个更加公平与可持续的健康老龄化社会。
研究的后续工作将检验这些发现的普适性,并推动产生可负担、可推广的干预方案,最终回答人类是否还能再一次将寿命的上限推向新的高度。 。