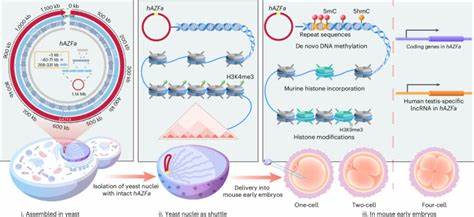
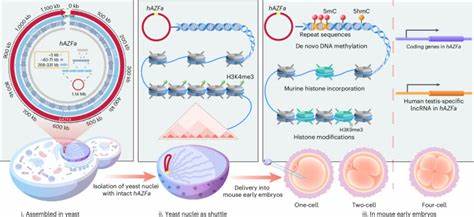
基因组合成技术作为生命科学前沿的关键领域,近年来取得了令人瞩目的进展。传统上,科学家们多聚焦于基因断片或小段DNA的编辑和组装,而实现百万碱基级(Mb级)连续人类DNA的合成与递送,始终面临技术瓶颈。近日,一项创新研究成功实现了合成并将完整的1.14 Mb的人类AZFa基因组片段递送至小鼠早期胚胎,标志着基因组写作和功能研究进入全新阶段。该研究不仅解决了大型、高度重复序列DNA的合成难题,还创新性地发展了一套Stable yeast nucleus Isolation for Chromosome Extraction(SynNICE)方法,用于从酵母细胞中提取完整染色体,并高效注入到小鼠代孕卵母细胞中,成功实现了跨物种人类DNA的体内表达和表观遗传重塑。合成Mb级DNA的组装多采用分步、联合重组策略,将数百个5.5 kb左右的短片段准确组装成数十个40~70 kb的中间片段,随后通过酵母细胞不同交配型的联合和CRISPR-Cas9定点切割促进大片段的高效连接。该流程通过酵母强大的同源重组机制和多轮筛选,确保了高度重复序列组装的准确性和连续性。
利用酵母作为组装及存储平台,不仅避免了细菌系统500 kb DNA不稳定的限制,也解决了大型DNA纯化过程中易断裂和甲基化污染的问题。在分离阶段,SynNICE技术创新地采用机械解离配合化学抑制核酸酶活性及多胺维持染色体紧缩,成功获得含有完整人类合成染色体的完整酵母细胞核。该细胞核不仅保持了染色体的三维染色质构象,也保护了DNA免受体外断裂,且可长期冷冻保存便于后续实验。通过激光显微注射技术,将这些细胞核注入至小鼠成熟卵母细胞中,实现在早期胚胎内的合成人类DNA的跨物种导入。研究发现,在小鼠胚胎细胞环境中,这段人类基因组DNA能够迅速经历染色质结构的转变,包括鼠源组蛋白的自发替换和DNA甲基化的从零开始建立。聚焦DNA甲基化,以往认为甲基化依赖于遗传信息制定但本实验表明在无任何预存甲基化信息的人造染色体上,甲基化趋向富集在重复序列区域,且这一过程与H3K9me3修饰强化无关,这为探究去预制的表观遗传状态如何被新环境感知及建立提供了关键见解。
同步的RNA测序结果显示,合成人DNA片段内的关键基因如DDX3Y和UTY在小鼠早期胚胎四细胞阶段开始表达,且其表达受动态DNA甲基化调控。此现象与人类早期胚胎内相似基因的表达时序吻合,揭示外源大型合成DNA在异种细胞内激活与特定发育阶段内环境的协调性。该研究技术平台的意义不仅在于提供了合成大规模人类基因组区域的标准方法,亦突破了将如此大片段DNA高效、完整地递送至多细胞哺乳动物胚胎的技术瓶颈。作为研究表观遗传构建、基因表达调控及基因组功能的“空白画布”,该技术能够帮助科学家从“零”开始观察染色质调控机制,实现多基因及复杂调控网络的整体化研究。未来,该方法有望被用于人工染色体及大型基因组构建,甚至结合人工染色体载体系统,实现更加稳定的转基因哺乳动物模型开发,推动疾病基因治疗、发育生物学和合成生物学研究的发展。此外,通过优化该技术,研究人员或能催生出配套的Mb级DNA递送机制,促进在多种哺乳动物细胞系及体内组织的应用,助力基因组写作进入突破规模基因片段传递限制的新时代。
此次突破也为解码物种间基因组调控差异提供了实验方案,通过合成完整人类基因组片段并在小鼠环境中观察其表观遗传及转录反应,有助于解析基因组保守与变异如何影响表观遗传修饰及基因表达,对理解物种进化和疾病机制有重要启示。总的来说,合成Mb规模人类DNA及其成功递送小鼠胚胎的研究开辟了合成基因组学新领域,用顶尖分子生物学与遗传工程手段构建了研究哺乳动物基因组调控的高精度平台,对未来精准基因治疗、生命科学基础研究及合成基因组构建产生深远影响。随着合成DNA技术、核注射与胚胎操作技术的不断提升,合成大规模复杂基因组构建将迈入实用阶段,为精准操控和理解基因组功能奠定坚实基础。