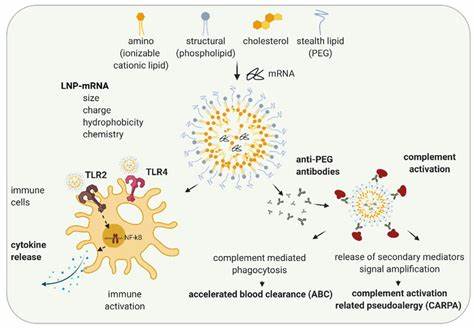
肠道炎症性疾病(IBD)是一类复杂且影响患者生活质量的慢性疾病,随着发病率的持续上升,寻找高效且安全的治疗方法愈发迫切。传统的炎症缓解药物往往存在疗效有限、副作用明显的短板,近年来基因疗法及相关核酸药物的崛起为肠道炎症的治疗带来新的突破口。锁核酸(LNA)作为第三代反义寡核苷酸,因其卓越的结合亲和力和靶向性凸显出良好的治疗潜力,但高剂量需求及治疗过程中可能出现的副作用限制了其临床应用。科研团队近日通过将锁核酸装载于脂质纳米颗粒(LNPs)中,实现了针对肠道炎症的精准递送,大幅降低有效剂量并增强疗效,开辟了肠炎治疗的新路径。锁核酸具体而言,是在寡核苷酸分子中通过化学修饰,利用氧甲基桥连接核糖环的第二和第四碳原子,从而提高分子刚性和结合目标RNA的稳定性。这种结构使得锁核酸在与互补核酸结合时,表现出高达数倍于传统反义核酸的亲和力和识别精度。
然而,锁核酸分子本身的高度亲和力虽有利于靶向,但也可能导致体内与非靶标的非特异结合、基因表达的非预期改变。此外,负电荷特性使其细胞膜穿透性较差,限制了细胞内的递送与作用。由此,如何提升锁核酸在体内特定靶点的递送效率,降低所需剂量,成为研究的关键所在。脂质纳米颗粒作为一种成熟的非病毒载体,具备稳定包裹核酸、保护核酸免受酶降解以及促进细胞摄取的优势。其核心成分为可在不同pH环境中改变电荷状态的可电离脂质,能在制备过程中与带负电的核酸紧密结合,进入体内后呈中性降低非特异性结合,进入细胞胞内的酸性内体时再带正电,有利于破坏内体膜,使核酸逃逸到细胞质,实现有效的细胞内递送。这种独特的电荷和结构转变机制使LNPs成为目前核酸药物递送领域的佼佼者。
在最新的研究中,科研人员合成并筛选了八种全新设计的可电离脂质,以组装核酸载体并测试其稳定性、安全性及递送效率。基于其结构多样性,包括亚油基链和可生物降解的酯键侧链,在体外细胞模型中进行活性评估。通过载入一种切换剪接的锁核酸序列,利用分子技术精确量化靶标剪接变异,实现剂量效力评估。结果显示,多个LNP配方显著提高锁核酸的细胞内活性,最佳配方使有效剂量相比裸核酸降低了近30倍,并在细胞存活率上保持良好的安全性表现。随后,研究团队将最优脂质15配方装载针对肿瘤坏死因子α(TNFα)的锁核酸,用于炎症性肠病小鼠模型的系统性递送。TNFα是肠道炎症中的关键介质,长期以来成为IBD治疗的重要靶点。
动物实验中,低剂量LNA-LNPs组表现出显著的TNFα表达抑制及炎症相关细胞因子显著下降,临床表现如体重下降得到改善,肠道组织结构修复,炎症细胞浸润明显减少。重大的发现是,尽管剂量远低于传统用量,炎症缓解效果不减,更加突显了载体系统的高效递送功能。通过体内成像技术和流式细胞术分析,脂质纳米颗粒在炎症状态下选择性富集于肠道的血管内皮细胞及炎症相关的髓系免疫细胞,如巨噬细胞和中性粒细胞,有效实现了炎症靶向,减少了非靶器官的累积和潜在毒性风险。生化检测显示肝功能指标无显著异常,表明载体和载体-核酸复合物在使用剂量下安全性较高。此项工作不仅在学术上首次展示了LNP递送锁核酸治疗肠道炎症的强大潜能,也奠定了推动其向临床转化的重要基础。目前,非包被的LNP呈现的是系统性分布特点,在精准性和靶向性方面仍有提升空间。
未来研究将致力于进一步修饰脂质纳米颗粒表面,纳入抗体或受体特异性配体,以实现细胞种类的定向递送,减少药物的全身暴露及副作用。与此同时,采用更复杂、更贴近临床的慢性肠炎模型将更真实地评估该疗法的长期疗效与安全性。生物相容性纳米载体技术正成为新一代核酸药物实现精准递送的关键。锁核酸的高亲和结合与脂质纳米粒的有效包载及内体逃逸能力相结合,可显著提升治疗的效率与安全性,解决传统核酸疗法面临的瓶颈。肠道炎症治疗中的此项创新研究不仅为IBD患者带来更多福音,也为基因疗法领域提供了新思路。整体而言,锁核酸通过脂质纳米颗粒实现的精准递送,展现出剂量降低、安全性提升和治疗效果显著的新优势,预示着未来核酸药物发展方向及炎症性疾病治疗的革新前景。
随着相关技术的成熟和临床试验的推进,相信其将成为个性化医疗和精准治疗的坚实基石,造福更多患者,改善全球肠道炎症疾病的治疗格局。 。