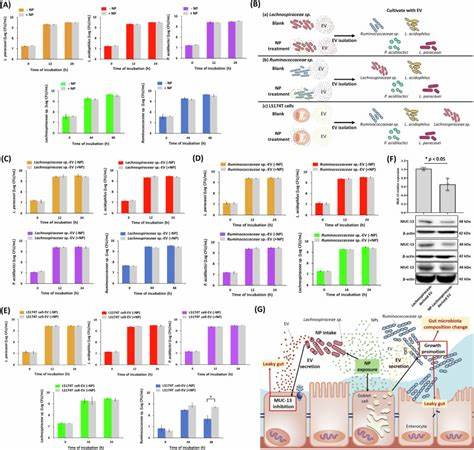
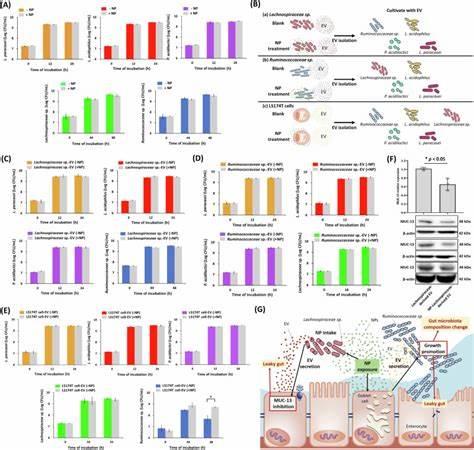
随着塑料制品的大量使用和环境中的塑料降解,纳米级塑料颗粒(简称纳米塑料,NP)已经成为一个不容忽视的新型污染源。特别是聚苯乙烯纳米塑料,因其广泛应用于包装、日用品等领域,经食物链进入人体,带来了肠道环境破坏的潜在风险。近年来,相关研究逐渐揭示纳米塑料对肠道微生态系统及其屏障功能的影响机制,为理解环境污染与肠道健康之间的联系提供了重要线索。肠道不仅是人体最大的免疫器官,同时也是丰富的微生物生态系统所在地,维持肠道屏障的完整与微生物群落的平衡对健康至关重要。纳米塑料因微粒极小,能够穿透肠道组织,积累在肠道不同部位,尤其是回肠和结肠。研究显示,长期摄入聚苯乙烯纳米塑料会引起小鼠体重增加,虽尚未观察到肝肾功能的明显损害,但肠道屏障功能的紊乱却十分明显。
这种紊乱表现为紧密连接蛋白如ZO-1与Occludin的表达明显减少,从而导致肠道通透性升高,即肠漏现象。肠漏不仅使有害物质更易穿透肠黏膜进入血液循环,诱发全身炎症,还可能破坏肠道微生态的稳定。科学家通过体内外实验发现,纳米塑料能促进特定微小RNA(miRNA)在肠道组织内表达异常,如mmu-miR-501-3p和mmu-miR-700-5p等,它们通过靶向肠道紧密连接蛋白的基因,抑制其正常表达。这些miRNA主要通过宿主细胞释放的细胞外囊泡(Extracellular vesicles,EV)传递,成为纳米塑料破坏肠道屏障的关键媒介之一。除此之外,纳米塑料还影响肠道黏蛋白,特别是MUC-13的表达。黏蛋白作为肠道屏障的重要组成部分,不仅构筑了物理屏障,还调节微生物群落的定植。
研究证实,纳米塑料的干扰导致MUC-13表达显著下降,进而削弱了肠道的防御能力。分析发现,miR-700-5p也能靶向MUC-13基因,减少其表达,进一步印证了miRNA介导的调控机制。肠道微生态方面,纳米塑料暴露引起了特定细菌群落构成的变化。尽管整体微生物多样性变化并不剧烈,但某些菌群如Ruminococcaceae的丰度显著上升,而有益菌群如Lactobacillaceae则相对减少。流式细胞技术结合16S rRNA测序的实验表明,纳米塑料主要被肠道内的Lachnospiraceae家族细菌摄取。这些摄取纳米塑料的细菌随后释放的EV,能够抑制宿主肠道细胞的MUC-13表达,形成负反馈循环,加剧肠黏膜屏障破坏,促进肠道微生态失衡。
同时,纳米塑料处理后的宿主细胞,尤其是肠道杯状细胞,释放的EV数量增加,这些EV又促进了Ruminococcaceae的生长,进一步扰动菌群生态。虽然实验中纳米塑料并未直接抑制肠道细菌的生长,说明菌群变化主要是间接通过宿主调节和细胞外囊泡介导的交互作用实现的。纳米塑料通过调控这两类EV的产生和成分,搭建起宿主与微生物间复杂的信号桥梁,产生了深远的影响。这不仅加深了我们对纳米塑料对肠道微生态机制的认识,也强调了细胞外囊泡作为信息传递载体的重要性。相关研究还指出,Ruminococcaceae的异常增多与多种疾病有关,包括自闭症谱系障碍、肝纤维化及神经退行性疾病等,提示纳米塑料可能通过微生物和宿主途径,间接影响宿主健康。鉴于纳米塑料在环境中的持续累积趋势,其对人体肠道健康带来的长期潜在风险不容忽视。
在预防和治理方面,研究建议应从减少纳米塑料环境排放入手,同时加强对食品安全链的监控,降低纳米塑料对人体摄入。未来科学研究还应进一步探讨纳米塑料对人体其它重要细胞类型的影响,完善相关毒理学评价体系。总之,聚苯乙烯纳米塑料通过改变肠道细胞miRNA表达、干扰细胞外囊泡的功能、破坏肠道紧密连接蛋白和黏蛋白表达,以及重新塑造肠道菌群结构,显著扰乱肠道微环境,威胁宿主的肠道健康和整体生理功能。深入理解这些分子机制,有助于制定更有效的环境保护政策和公共健康干预措施,保障人类健康免受纳米塑料危害。