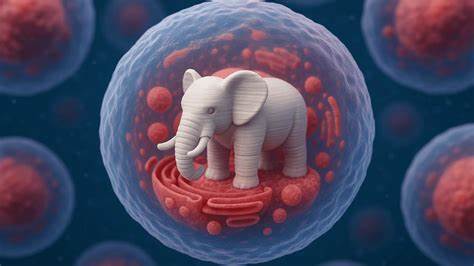
近年来,3D打印技术迅速发展,广泛应用于制造业、医疗器械和生物工程领域。然而,科学家近日实现了一项令人震惊的创新:首次在活细胞内部成功3D打印出微观结构,其中最引人注目的是一只长约10微米的微型大象。这一突破不仅展示了3D打印技术的巨大潜力,也开启了细胞内精密操控的新篇章,为生命科学研究和未来医学应用注入了无限想象空间。 此次研究由斯洛文尼亚约瑟夫·斯特凡研究所的物理学家Matjaž Humar领导,团队利用双光子聚合技术(Two-Photon Polymerization)在人体细胞内进行创新实验。双光子聚合是一种利用激光聚焦于极小体积区域,使光敏液态树脂(光刻胶)瞬间固化的方法。通过精准控制激光焦点位置,科学家们得以在纳米至微米尺度范围内打印出复杂精细的微结构。
实验过程中,研究团队首先采用显微注射技术将光刻胶注入细胞内。这一环节极具挑战性,因为细胞膜极其脆弱,任何机械刺激或液体注入都会带来极大的细胞死亡风险。此外,大多数光刻胶对细胞具有一定毒性,因此筛选兼顾打印性能和细胞兼容性的光刻胶成为关键。经过多次试验,研究人员选定了一种相对温和的光刻胶,并成功实现了在活细胞内3D打印微结构,同时确保部分细胞在打印后仍能存活并继续分裂。 该技术的成功展示,标志着科学家们首次能够直接在活细胞环境内构建功能性微结构,有别于传统通过吞噬机制(吞噬细胞吞食外部物体)实现的细胞内部植入。传统方法局限于某些特定细胞类型,且难以控制结构形状和尺寸。
而3D打印则提供了前所未有的自由度和复杂度,可以设计多种形状,如象征性的微型大象,甚至条形码状结构用于细胞追踪。 不仅如此,研究团队还打印出微型激光器。这种由微小球体组成的结构能够在受到激光照射时发射特定波长的激光光,可作为细胞的“光学指纹”,用于识别、跟踪甚至监测细胞内环境变化。微激光器的灵敏性预示着未来有望在细胞水平上实现高分辨率的生物传感器应用,检测特定分子或生物信号。 然而,技术尚处于初步阶段,细胞存活率仍有待提高。注射液体和光刻胶的过程对细胞造成很大物理和化学压力,许多细胞会在24小时内死亡。
科学家期待通过改进更为细胞友好的光刻胶、优化注射技术以及开发能够穿透细胞膜的光敏材料,提升细胞打印成功率和生存率。 这项新兴科技不仅仅是展示微观打印的技术炫酷,更重要的是其广泛潜在的科学与医用价值。未来,科学家可以利用这些微型结构制造细胞内部的“机械臂”、“弹簧”或“隔离障壁”,用于操纵细胞内的力学环境,深入研究细胞器功能和生物力学机制。同时,通过非基因改造方式对活细胞进行精细调控和标记,避免传统基因编辑带来的伦理和安全问题。 这一创新拓宽了生物技术与纳米技术的交叉领域,有望促进个性化医疗发展,助力实现精准诊断和高效治疗。由于可以在细胞内构建复杂且功能多样的微结构,未来医学研发中可以设计更智能的药物递送系统、动态细胞传感器,甚至微型生物机械器件,深刻改善疾病治疗和生物实验的方法。
科技界专家对此表示高度关注和期待。德国海德堡大学的生物物理学家Kerstin Göpfrich评价道,细胞内部3D打印让人惊讶,一些细胞存活下来继续分裂更是不可思议,预示着该技术巨大的应用前景。科隆大学的光学物理学家Malte Gather也强调,这种可以在活细胞内打印复杂结构的技术,象征着“大在小中的奇迹”,具有重要科学意义。 未来几年,随着技术成熟和细胞友好型材料的开发,3D细胞内打印有望成为生命科学研究的标准工具。其影响力将渗透到基础细胞生物学、再生医学、药物筛选以及合成生物学领域。研究人员还计划探索利用打印的微结构调节细胞行为,控制细胞形态变化,以及实现细胞内的微观机械装置,提高细胞功能的可控性和智能化水平。
同时,这种技术也引发了伦理和安全层面的广泛讨论。尽管目前尚非基因编辑,但在细胞内制造人工微观装置仍需细致评估对细胞自然功能及生物安全的长期影响。科学界呼吁制定相关规范和监管措施,确保快速发展的技术在科学探索与临床应用中平衡创新与安全。 总体来看,首次在活细胞内3D打印微型大象及多样微结构标志着生命科学研究技术的重大飞跃。它不仅突破了过去只能在细胞外打印的限制,更将微观制造推向了细胞级别,为解析生命奥秘提供前所未有的精准工具。随着这一方向的不断深入,未来人体细胞将不再仅是生命的基础单位,也可能成为微型制造工厂,融合自然与人工创造力,开创生物医学的新纪元。
。