脊髓损伤(SCI)是一种严重的神经系统创伤,常导致患者丧失运动与感觉功能,生活质量严重下降。尽管临床对SCI的管理有所改进,患者在功能恢复方面仍面临巨大挑战。传统治疗手段多预防进一步损伤与缓解症状,难以实现神经组织的真正修复。因此,科学家们不断探索颠覆性的再生医学策略,以修复受损的神经回路,恢复脊髓功能。 近年来,干细胞疗法为SCI的修复研究注入了新的生命力。尤其是源自人诱导多能干细胞(iPSC)的区域特异性脊髓神经前体细胞(sNPCs)表现出极高的再生潜力。
这类细胞能在损伤部位分化为多种脊髓神经细胞类型,包括神经元和少突胶质细胞,从而替代失去或受损细胞,建立新的神经网络。然而,简单的细胞注射往往因缺乏结构支撑与空间引导,导致细胞存活率低、迁移差、功能整合不足。 针对上述问题,3D打印技术被引入脊髓损伤领域,成为提升细胞治疗效果的关键工具。3D打印使得科学家能够利用多种材料,制造出具有高度可控微结构、模拟脊髓组织构架的三维生物支架。这些带有微尺度通道的支架不仅为种植的sNPCs提供机械支撑和空间定位,还通过引导轴突沿预设方向生长,促进细胞间的精准连接。此举显著促进了神经网络的成熟和功能形成。
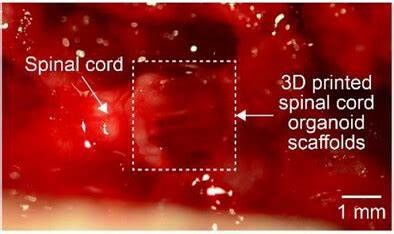
基于此理念,研究团队开发出一种创新性的3D打印脊髓类器官支架。首先,采用人类iPSC诱导获得的区域特异性sNPCs,保证细胞来源的临床相关性与免疫耐受性。接着,利用多材质挤出式3D打印技术,在硅胶材料的立体支架内打印出三个尺寸约为200微米宽且440微米高的微通道。随后将含有sNPCs和富含生长因子的Matrigel细胞墨水注入通道中,形成细胞载体。这种设计不仅实现了细胞在三维空间中的均匀分布,还模拟了体内脊髓灰质与白质的结构。 支架制造过程中,选用硅胶材料是基于其生物相容性强、氧气透过率高和稳定性好的优点,为耗氧量大的神经细胞提供理想的生存环境。
打印完成后,细胞载体在体外培养数周,观测到sNPCs在通道中沿着方向有序生长,分化为多种脊髓特异性神经元亚型,如V0、V1、V2a中间神经元,并形成成熟的轴突和树突网络。免疫荧光染色确认细胞持续表达神经元标志物MAP2和SMI312,显示出良好的存活和功能状态。RNA测序进一步证实3D生物打印组的基因表达显著上调与脊髓组织发育、区域特异性和功能神经元形成相关的基因簇,较传统二维培养显示出更接近体内生理的分化谱系。 体外电生理测试揭示,这些3D打印支架内培养的sNPC衍生神经细胞能产生动作电位,表现出功能成熟的神经元电生理特性,显示出比二维培养更强的激发性和信号传导能力。此结果强调了三维微环境及机械导向对促进神经细胞功能成熟的重要作用。 将成型的3D脊髓类器官支架植入到大鼠严重脊髓截断模型的损伤间隙后,研究团队通过Basso、Beattie和Bresnahan (BBB)运动评分系统对动物的运动恢复进行了长期追踪。
相比于仅受伤或仅植入空白支架的对照组,接受3D打印类器官支架移植的动物表现出显著的运动功能恢复趋势,尤其从移植后第3周开始,功能评分持续提升,至第12周达到了较高水平。这显示出类器官支架显著增强了神经回路重建的效果。 同时,运动诱发电位(MEP)检测也反映出神经传导功能的增强,3D打印脊髓类器官组的肌肉反应电压幅度明显高于其他组别,证明其有效促进了从大脑皮层传向脊髓下端的运动信号传递。 组织学分析通过免疫标记揭示移植物内植入的人类细胞不仅存活且大部分分化为神经元,同时还有一定比例成为少突胶质细胞。轴突与树突通过支架微通道伸展,成功穿越损伤间隙,且在人源细胞标志SC121和神经标记NF200的共定位下显示与宿主神经组织的良好融合。更关键的是,这些细胞参与形成了神经突触网络,说明其能够在生理功能层面与宿主神经元建立连接,从而实现信息传导桥接作用。
该项目的成果表明,通过3D打印支架构建的脊髓类器官,不仅重现了脊髓组织的空间布局和细胞多样性,还促进了功能神经网络的成熟,克服了传统细胞移植的诸多瓶颈。未来,这一技术有望进一步发展,通过优化支架材料的生物降解性和力学性能,结合多区域特异性神经细胞种类,实现更复杂的脊髓组织再生与感运动通路恢复。 此外,研究团队还规划了将背侧和腹侧区域特异性sNPC组合打印为分层结构,模拟脊髓感知与运动调控的空间分布,以更全面地恢复神经功能。同时,借助响应生物材料和解剖参考数据,力求实现完全自动化的个性化支架制造,满足不同损伤类型与患者需求。 综上所述,3D打印脊髓类器官支架开辟了SCI治疗的新路径,体现了再生医学与先进制造技术融合的巨大潜力。依托人源细胞与精准空间构建,该技术不仅为SCI患者带来了功能恢复的希望,也为神经科学、组织工程与个性化医疗的发展注入了新动力。
随着材料科学、生物工程和临床研究的持续进步,未来相关技术有望进入临床试验阶段,推动SCI治疗迈向全新高度。 。