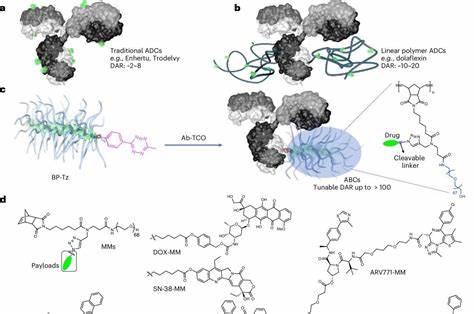
癌症作为全球范围内的重大健康挑战之一,传统的化疗方法固然有效,但其系统性副作用不容忽视。化疗药物往往无法精准定位肿瘤,导致正常细胞受到损伤,引发恶心、脱发、免疫力下降等多种不良反应。麻省理工学院(MIT)科研团队近日突破性地提出一种新型"瓶刷"纳米粒子系统,能够携带海量化疗药物并通过抗体精确导向肿瘤细胞,实现高效且低副作用的靶向治疗,掀起癌症治疗领域新的革新浪潮。 瓶刷式纳米粒子的设计灵感来源于其独特的形态结构,类似于瓶刷:一条高分子主链像刷柄,附着着许多药物"毛刷"。通过这种结构,单一的纳米粒子可以承载数百个化疗药物分子,远超目前临床上常用的抗体药物偶联物(ADC),后者通常仅能携带不到十个药物分子。此种高载药量使得治疗方案更灵活,可以使用更多样的化疗药物组合,甚至是以往因效力不足而被限制使用的药物,如多柔比星和紫杉醇。
更重要的是,瓶刷粒子通过共价键与针对癌细胞表面特定蛋白的抗体相连,这些抗体犹如"导航器",帮助纳米粒子精准锁定肿瘤部位。例如,针对HER2蛋白的抗体可定位于某些乳腺癌细胞,靶向MUC1的抗体则适用于卵巢癌及肺癌等肿瘤。经过这种精准导向,纳米粒子能够在肿瘤局部释放药物,大幅降低健康细胞的暴露风险,从根本上减少化疗的不良反应。 此外,瓶刷纳米粒子中药物以"前药"形式连接,这意味着药物在体内初步为非活性状态,只有在肿瘤微环境中特定酶的作用下激活释放,进一步确保治瘤的特异性与安全性。部分药物分子甚至能立刻释出,攻击附近不表达目标蛋白的肿瘤细胞,扩大治疗作用范围。纳米粒子本身可被癌细胞吞噬,通过细胞内分解精确释放药物,强化细胞杀伤效应。
基于小鼠乳腺癌和卵巢癌模型的实验结果显示,该技术能够显著缩小甚至彻底消除肿瘤,效果远优于现有未加抗体的药物纳米粒子输送体系,且其剂量仅为传统化疗药物的百分之一。相比市场上已有的ADC药物如T-DXd和TDM-1,瓶刷纳米粒子所携带的抗体-药物偶联物(ABC)疗法显示出更高的疗效和更少的副作用,标志着靶向化疗治疗进入全新阶段。 "瓶刷"纳米粒子的灵活性还体现于其能够同时负载多种药物成分,不仅限于传统化疗药,还能搭载诸如PROTAC(蛋白降解靶向嵌合体)、微管抑制剂和DNA损伤剂组合。未来,研究团队计划扩展至免疫疗法药物,比如STING激活剂,以增强抗癌免疫反应,实现化疗与免疫治疗的协同增效。通过调整抗体种类,可针对不同癌症类型快速定制个性化治疗方案,拓宽应用范围。这一设计体现了精准医疗的理念,为癌症患者带来了全新的希望。
在合成工艺方面,团队采用了高效且可控的点击化学技术,将多个瓶刷聚合物连接到单个抗体上,确保连接稳定,药物释放可控。这种方法不仅提高了药物载量,也方便了生产规模化,为未来药物临床转化奠定坚实基础。研究团队正积极与制药企业合作,推动该技术的临床前研究和人体试验进程。 综合来看,麻省理工学院开发的"瓶刷"纳米粒子抗体偶联药物系统代表了癌症治疗领域的重大创新。它突破了传统ADC载药量的限制,扩展了可使用药物的种类,实现了更精准、更高效且副作用更低的治疗模式。未来,随着技术优化和临床验证的深入,瓶刷纳米粒子有望成为多种癌症治疗的新一代标准,造福更多患者。
随着纳米技术和生物制药的不断融合创新,癌症精准治疗正朝着多样化和个性化方向迈进。瓶刷纳米粒子技术不仅丰富了癌症药物递送手段,还为科学家提供了灵活设计药物组合的全新工具,有效克服了化疗耐药和副作用难题,开启了肿瘤治疗的新纪元。未来十年,凭借此类前沿技术的持续发展,将在提高患者生存率和生活质量方面发挥重要作用,为全球抗癌事业贡献卓越力量。 。