碱基编辑技术自诞生以来,作为一种精准、高效且无需引入双链断裂的基因组改造工具,迅速引起了生物医学界的广泛关注。特别是在纠正单核苷酸变异相关的遗传性疾病中,碱基编辑显示出独特的临床应用潜力。其原理依托于将特定的脱氨酶酶域融合到Cas9核酸酶的失活或降活变体上,利用导向RNA将编辑器精确定位到靶标DNA序列,实现目标碱基的转换,例如腺嘌呤到鸟嘌呤(A•T→G•C)或胞嘧啶到胸腺嘧啶(C•G→T•A)的碱基转变。然而,随着技术的深入应用,碱基编辑器普遍存在的旁观者编辑问题逐渐显现,成为限制其临床应用的关键难点。所谓旁观者编辑,指的是在目标位点附近区域的非目标碱基也遭到编辑,导致基因组产生意外变异,进而影响基因功能和安全性。当前高活性碱基编辑器如ABE8e虽然具有优异的编辑效率,但其宽广的编辑窗口却不可避免地促进了旁观者碱基的脱氨基修饰,增加了不良编辑事件发生的概率。
为解决这一瓶颈,科学家们亟需开发出既能维持高效编辑又能显著限制旁观者编辑的新一代碱基编辑工具。 针对这一挑战,最新研究提出了一种以结构为指导的高效蛋白重构策略,将天然的寡核苷酸结合模块嵌入到腺嘌呤脱氨酶TadA-8e的活性中心。该策略不仅提升了编辑的特异性,还实现了碱基编辑窗口的大幅度收窄。其核心理念在于,天然RNA结合蛋白如人类Pumilio1的RNA结合结构域,具备高度模块化且特异性强的核酸单链结合特征。通过在脱氨酶结构中模拟引入类似的芳香族氨基酸侧链堆积以及氢键和电荷相互作用,能够稳固脱氨酶与非靶链DNA的结合姿态,抑制粘合位点附近非目标碱基的脱氨基反应。这种精密的构象调控,有效控制了编辑窗口长度,显著减少了因编辑范围宽泛带来的旁观者编辑。
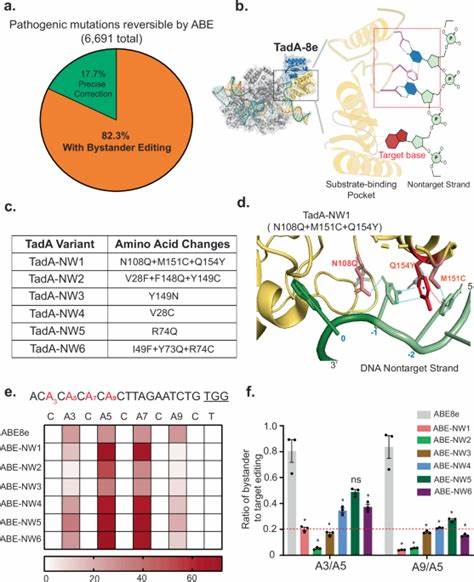
经过系统筛选与功能验证,研究团队研发出多种TadA的窄窗口变体,统称为TadAs-NW。其中的代表性变异体TadA-NW1,在与Cas9 nickase结合后,在若干内源基因组位点中展示出4个核苷酸宽度的编辑窗口,远小于传统ABE8e的10碱基窗口。重要的是,TadA-NW1的靶向编辑效率保持与ABE8e相当,同时旁观者编辑比率显著降低。对比传统大规模饱和突变筛选法,该策略通过结构分析实现从分子层面入手的定向设计,大幅节省了壁垒高的筛选与鉴定成本,为碱基编辑器的快速迭代提供了范例。试验结果表明,TadA-NW1对于不同Cas9 PAM变体均有效,拓展了其在基因组多样靶点上的应用潜力。 此外,该策略的多面性还体现在可重编程能力上。
即便是腺嘌呤脱氨酶TadA领域,也能通过相应突变,拓展为高效的胞嘧啶脱氨酶功能,或执行腺嘌呤转变为胞嘧啶的转化反应。研究中引入TadA-NW1相关突变的Td-CBE-NW版本便展现了更精确的C·G→T·A编辑,旁观者编辑比率大幅下降。类似地,ACBE-NW用于A·T→C·G的转变编辑,也实现了编辑窗口的有效缩窄和准确率提升,为基因编辑技术的多样化应用奠定基础。 理论与实验结合使研究集合多重严苛考验,验证了TadA-NW1及其衍生碱基编辑器的安全性和精准性。针对DNA脱靶编辑问题,研究团队采用切合实际的Cas9依赖性和Cas9非依赖性离线检测法,结果显示TadA-NW1基因脱氧核糖核酸编辑的非靶向活性远低于ABE8e,意味着其编辑活动更集中于靶向位置。此外,经过全基因组测序分析,未发现TadA-NW1引入新的高频SNV,进一步巩固了其潜在的临床适用价值。
在实际疾病模型验证中,开发者将TadA-NW1衍生编辑器应用于纠正导致囊性纤维化(CF)的CFTR W1282X基因突变。这一突变因引入早停密码子阻碍CFTR蛋白正常合成,是CF患者群体中最常见且治疗难题之一。通过精准设计多个导向RNA灵活调整靶点位置,结合拥有窄编辑窗口的TadA-NW1,实验获得迄今最高水平的纯净矫正率,达到了超过30%的无旁观者基因组变异修复效果。相比传统ABE8e,尽管后者具备较高编辑效率,但伴随高比例副作用编辑,导致CFTR蛋白合成和功能受损。TadA-NW1不仅有效提高了矫正纯度,还显著提升细胞中CFTR蛋白的表达量和功能活性,彰显了其作为基因治疗工具的实际潜力。 碱基编辑技术的未来必然倚赖于精准与安全的平衡,而结构引导的蛋白质工程为此提供了有效路径。
从广义角度看,整合天然分子结合模件以稳定编辑酶与核酸底物相互作用,是优化编辑器特性的经典策略。伴随人工智能推动的蛋白质结构预测工具如AlphaFold的兴起,未来基于三维结构的设计将更为普及与精准,这无疑将催生更多符合临床要求的基因编辑工具。同时,针对不同Cas9及其变异体的跨平台适配也正逐步突破,预计将为灵活多样的临床应用构筑强大技术支撑。 对于碱基编辑技术的推广和应用,除了酶的工程优化外,相关导向RNA的设计、多重编辑位点的协调控制、细胞传递效率及免疫原性等问题也不可忽视。研究团队针对CFTR W1282X精心挑选非典型PAM定位的sgRNA,完美配合窄窗口编辑器,实现高效精准的突变修复。此举体现了整体策略的系统化与个性化结合,也启发后续研究从整体设计入手,孵化定制化基因治疗方案。
综上所述,基于结构的碱基编辑器工程策略代表了基因治疗研发的前沿方向。通过借鉴天然寡核苷酸结合模块,将脱氨酶的结合特性进行革新,科学家成功打造出窄编辑窗口且高效靶向的碱基编辑器,有效减少了旁观者编辑,提升了临床安全性。特别是在囊性纤维化等遗传疾病的矫正中,展现了极具应用价值的成果。未来,伴随精准基因组学、蛋白质工程及单细胞技术的协同发展,碱基编辑有望实现更加个性化、精准安全的遗传病治疗蓝图,推动人类医学迈向新纪元。 。