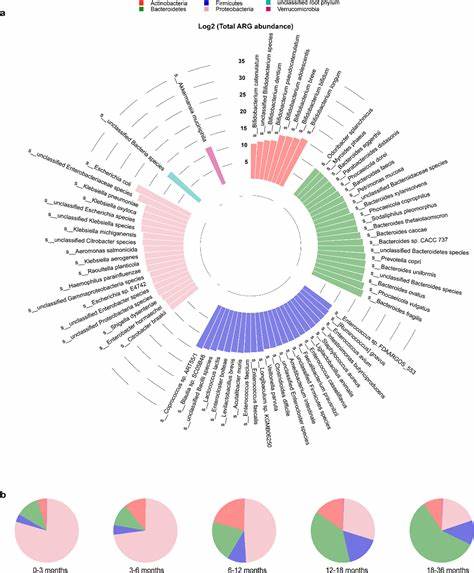
抗生素耐药性作为全球公共健康领域的严重挑战,其发生和传播机制正在受到越来越多的关注。特别是在婴儿阶段,肠道微生物群的建立与抗性基因组(resistome)的动态变化之间存在着密切联系。尽管肠道细菌携带抗生素耐药基因本身不必然导致疾病,但由于微生物能通过水平基因转移共享抗性元素,是抗生素耐药传播的重要潜在来源。因此,深入理解早期肠道抵抗基因的时空演变及其潜在调控因素,对于预防耐药性扩散具有重要意义。最新发表于《Nature Communications》的研究基于丹麦ALADDIN出生队列,对56对母婴展开了长期随访,结合纵向定量宏基因组学技术,对婴儿出生后至五岁期间肠道耐药基因的复杂演变过程进行了系统性分析。研究发现耐药基因在生命的第一周便已出现,并于6个月时达到峰值,无论基因数量还是总体负荷均显著高于其他时间点,而随年龄增长则呈逐渐下降趋势,至24~60个月时趋向成年水平。
这种动态反映出婴儿肠道微生态系统快速变化的特点,也为早期阶段干预预防耐药传播提供了时间窗口。令人瞩目的是,产道分娩方式是影响早期肠道抗性基因水平的重要决定因素,阴道分娩婴儿相比剖宫产婴儿显示出更高的绝对抗性基因负荷。此现象主要归因于母体产道中的大肠杆菌等携带丰富抗性基因的菌株向新生儿的垂直传播。进一步分析指出,家庭出生的阴道分娩婴儿肠道抗性基因负荷高于医院出生者,暗示分娩环境对微生态早期定植的影响亦不容忽视。这一发现强化了母体菌群在塑造新生儿肠道抗性基因库中的关键角色,也强调了出生干预策略优化的必要性。在细菌群落层面,研究揭示肠道内耐药基因丰富的菌群主要集中在少数细菌门类,尤以大肠杆菌表现出最高的耐药基因多样性及载量。
值得注意的是,该菌种不仅携带大量多药耐药基因,还包含丰富的毒力因子,这提升了其作为潜在病原体的风险。除了大肠杆菌,克雷伯氏菌、柠檬酸杆菌及肠杆菌等菌属亦携带临床关注的重要抗性基因。这些组分精准定位为耐药基因在肠道微生物中的主要"承载者",为监测和精准调控提供靶点。探索微生态相互调控机制,研究特别关注早期肠道中双歧杆菌(Bifidobacterium spp)的作用。数据显示,携带芳香乳酸脱氢酶(aldh)的双歧杆菌亚种与大肠杆菌等耐药基因群体呈负相关,提示存在拮抗或竞争关系。鲜有研究通过直接实验验证了双歧杆菌代谢产物对耐药菌生长的抑制能力。
进一步的代谢组测定证实,双歧杆菌通过芳香乳酸脱氢酶生成多种芳香乳酸,如苯乳酸、4-羟基苯乳酸和吲哚乳酸,在肠内浓度达到抑制大肠杆菌及其他耐药菌生长的水平。体外实验中,相关芳香乳酸表现出强烈且浓度依赖的抗菌活性,有效抑制了包括大肠杆菌、克雷伯氏菌和柠檬酸杆菌在内的临床相关细菌的增殖。相比于乳酸和乙酸,这些芳香乳酸的抑菌作用更显著且可能具备pH独立机制,这为双歧杆菌通过代谢路径调节肠道耐药细菌提供了新视角。母婴菌株共识分析中,研究发现阴道分娩新生儿与母亲在大肠杆菌菌株上具有极高的相似度,特别是在家庭分娩的婴儿中更为显著,证明母婴之间具有实际的菌株垂直传递。该传递过程不仅导致新生儿肠道早期耐药基因的高负荷,也加深了两者肠道微生态的关联性。针对环境及干预因素,研究没有发现早期抗生素暴露会显著改变整体耐药基因负荷,这可能因婴儿肠道具有一定的稳态恢复能力,且后续时间节点的动态影响更加复杂,需更大规模研究去验证。
饮食类型在本队列中对耐药基因负荷无显著影响,但鉴于其它研究确认母乳喂养与双歧杆菌丰度密切相关,饮食因素仍不可忽视。整体而言,该研究系统揭示了婴儿肠道耐药基因组随时间的动态变化及其与微生物群落结构的复杂关联,强调了出生方式及早期重要微生物如双歧杆菌在抗性基因传播中的核心作用。芳香乳酸作为双歧杆菌代谢产物在抑制耐药菌增殖中的功能性作用,为未来通过益生菌或代谢物干预打造良性肠道环境、降低肠道耐药基因负担提供了科学依据。随着全球抗生素耐药危机日益严峻,针对婴幼儿时期肠道耐药基因库塑造机制的深入探索,将引领个性化微生态产品及公共卫生策略的创新。未来研究应聚焦于扩大样本规模、评估不同族群及环境因素对肠道耐药性发展的影响,并构建以双歧杆菌及其芳香乳酸为核心的微生态调控框架,推进儿童健康与抗菌素敏感性的长远保障。 。