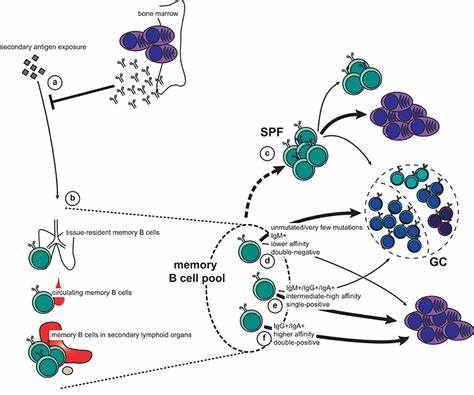
疫苗作为预防传染病的有力武器,其核心在于激活机体免疫系统产生持久有效的保护性抗体。记忆B细胞作为免疫记忆的重要组成部分,承担着在二次暴露时迅速产生高亲和力抗体的职责。近年来,科学家们逐渐认识到,记忆B细胞的反应不仅受细胞自身特性影响,还深受其所在微环境,尤其是巨噬细胞所在的淋巴结特定位点的调控。这一发现为疫苗研发带来了新的视角和突破。巨噬细胞,尤其是位于淋巴结亚被膜窦的CD169+亚被膜窦巨噬细胞(subcapsular sinus macrophages,SSMs),扮演着捕获和呈递淋巴中抗原的关键角色。它们通过与记忆B细胞的紧密相互作用,促进记忆B细胞的激活和命运决定。
最新的研究表明,疫苗注射部位及其相应引流淋巴结的记忆B细胞,表现出明显的定位依赖性差异。位于初次接种部位引流淋巴结的记忆B细胞倾向于重新进入胚中心(germinal center,GC)继续成熟和亲和力提升,而非引流结中的循环记忆B细胞更多转化为浆细胞,进行抗体快速分泌。这种定位依赖性反应受主导亚被膜窦巨噬细胞的调控,其功能状态和成熟度直接影响记忆B细胞的反应质量。动物实验中,阻断集落刺激因子1受体(CSF1R)以消耗SSMs后,发现记忆B细胞从亚被膜区域向淋巴滤泡深处迁移,原有定位优势丧失,记忆B细胞对疫苗再次刺激的胚中心重返及扩增显著减少,表明SSMs不仅维持记忆B细胞在亚被膜窦的定位,还决定其细胞命运。此外,通过同步给予不同抗原的交叉免疫实验发现,先前对一种抗原的免疫“启动”能使巨噬细胞进入预备激活状态,即使后续抗原非同源,该淋巴结仍可产生增强的记忆B细胞胚中心和抗体反应。这揭示了由巨噬细胞介导的微环境“免疫记忆”机制,打破传统对记忆B细胞仅靠自身程序的认识。
临床研究进一步验证了这一机制的意义。在针对新冠疫苗BNT162b2的临床试验中,与在首次接种相同臂部(引流至相同淋巴结)进行加强针相比,在对侧臂部接种增强免疫的受试者,早期抗体反应显著减弱。注射部位相同者产生更高效的广谱中和抗体,更丰富的抗原特异性B细胞克隆扩增,以及更显著的胚中心反应。这些差异在注射后首周尤为明显,却随着时间推移逐渐消失,提示定位依赖性反应对快速建立有效免疫防御至关重要。分子水平的分析显示位于引流淋巴结的记忆B细胞与巨噬细胞之间,存在多个关键的配体受体对相互作用,包括MIF-CD44、ICAM1-CD11b/18等,这些相互作用塑造了细胞的迁移行为、激活状态及其后续分化路径。记忆B细胞在引流淋巴结中表达促进胚中心分化的基因程序,而非引流淋巴结则更倾向于向浆细胞路线分化,反映出一种既受环境定位又具细胞内程序调控的复杂机制。
此类研究成果不仅为理解免疫记忆和疫苗效应提供了全新视角,也直接指导临床疫苗接种策略。简单调整疫苗加强针的注射部位,使其与初次接种保持一致,能够优化记忆B细胞的重新激活效率,加速高亲和力抗体的产生,增强对变异病毒株的广谱保护。未来疫苗设计可基于此,结合纳米颗粒载体和细胞靶向递送技术,更精确调控淋巴结内微环境,增强巨噬细胞与记忆B细胞的有效互动,进一步提升疫苗的保护范围及持久性。与此同时,亚被膜窦巨噬细胞作为关键的免疫调节节点,成为新型疫苗辅佐剂开发和免疫干预的潜在靶点。在重大呼吸道病毒全球流行的背景下,如新冠病毒、流感病毒等,针对不同病毒株频繁推送加强针已成为常规防控手段。理解并利用免疫定位依赖性记忆B细胞反应机制,有望在极短时间内提升群体免疫水平,为阻断传播和防止疫情爆发提供科学基础。
此外,研究还提醒我们,记忆B细胞异质性与其所在解剖位置密不可分,体内微环境的多样性和复杂性对免疫应答塑造至关重要,单纯依赖体外或异体细胞转移模型难以全面反映真实生理状态。面向未来,结合单细胞组学、空间转录组学和高分辨率活体成像技术,将进一步揭示免疫细胞间精细的空间动态关系及其对免疫记忆的影响。巨噬细胞与记忆B细胞间的相互“共生”关系,为免疫微环境中的细胞互作提供新范式,推动精准疫苗学的发展。总结而言,巨噬细胞在淋巴结亚被膜窦区域通过定位依赖性方式引导记忆B细胞的反应,是疫苗引发高效且持久免疫保护的关键。理解和利用这一机制,不仅能优化传统疫苗的接种策略,还将助力创新型疫苗研制,提升应对病毒变异及新发传染病的能力。未来精准调控免疫细胞定位及相互作用,必将成为疫苗科学和免疫治疗领域的重要前沿。
。