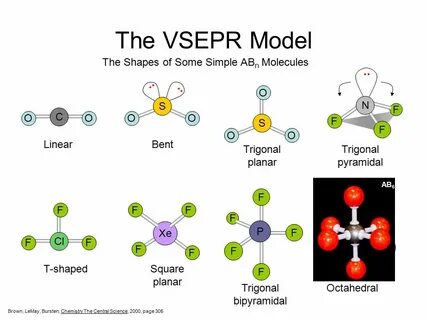
标题:VSEPR模型:揭示分子形状的秘密 在化学的世界中,分子的形状对其性质和反应性具有重要影响。要理解这种形状的由来,科学家们提出了一种名为VSEPR模型(价层电子对排斥理论)的理论,这一理论不仅揭示了分子形状的起源,还为我们提供了简便的预测方法。本文将探讨VSEPR模型的基础理论、应用实例以及其局限性,帮助读者深入理解这一重要的化学概念。 VSEPR模型是由两位化学家,罗纳德·吉莱斯皮(Ronald Gillespie)和罗纳德·奈霍姆(Ronald Nyholm)于20世纪60年代首次提出的。它的全称是“价层电子对排斥理论”(Valence Shell Electron Pair Repulsion Theory),这一名称准确地描述了模型的核心思想:分子中电子对之间会相互排斥,并依此决定分子的几何形状。 模型的核心理念是,分子中位于中心原子(通常被称为A)的价层电子对会通过相互之间的排斥力而尽量远离,从而形成最稳定的几何结构。
具体来说,当我们面临一个分子时,可以将其分类为ABn、ABnEm等类型,其中A表示中心原子,B表示与中心原子相连的原子,而E则表示孤立电子对。通过计数这些电子对和原子,我们可以使用VSEPR模型预测分子的几何形状。 例如,在分子水(H2O)中,中心原子是氧(O),它与两个氢(H)原子相连。此外,氧原子还有两个孤立电子对。根据VSEPR模型,水的分子几何形状是“弯曲”型,而不是理想的“正四面体”型。原因在于,两个孤立电子对通过排斥作用占据了比结合的氢原子更大的空间,从而使得H-O-H的键角小于109.5度,实际约为104.5度。
VSEPR模型可以用几何图形很好地表示不同的分子结构。例如,当分子中有两个电子对时(如BeCl2),它的几何形状是“线性”的,键角为180度;而在有三个电子对的情况下(如BF3),则形成“平面三角型”,键角为120度;当电子对增多至四个(如CH4)时,分子则呈现为“正四面体”形状。 模型的强大之处在于,它能够直观地反映出原子间的相对位置和各个原子之间的角度关系。对于许多简单分子,使用VSEPR模型来预测分子的几何形状不仅方便而且准确。 除了对简单分子的应用,VSEPR模型还适用于许多复杂分子,特别是在有孤立电子对的情况下。孤立电子对的存在会影响分子形状及其内部分子间的相互作用,这在化学反应中起到关键作用。
例如,硫酸(H2SO4)的分子结构可以用VSEPR模型进行分析,从而帮助理解其酸性及反应性。 然而,VSEPR模型并非没有局限性。它的适用范围主要局限于不太复杂的分子体系。对于许多过渡金属络合物或含有多个共价键的分子,VSEPR模型可能无法给出准确的预测。这是因为这些复杂的分子可能存在额外的因素,如强烈的金属-配体相互作用、电子传递等。而这些因素在VSEPR模型中并未考虑。
另外,有些分子在实际中显示的形状与VSEPR模型的预测有所不同。这可能源于存在多重共价键或原子半径的不同,以及电子的空间分布等因素所导致。这使得化学家在应用VSEPR模型时,不仅要考虑理论推导,还需借助实验和计算化学的手段来进行进一步的验证。 尽管如此,VSEPR模型依然是我们理解和预测分子形状的重要工具。在化学教学中,这一模型能够以简单易懂的方式帮助学生理解化学结构的原理,进而激发他们对化学的兴趣。通过形象化的图示和直观的推理,学生可以更好地掌握分子结构的变化和性质的关联。
总结而言,VSEPR模型以其独特的方式揭示了分子形状的秘密,通过电子对之间的相互排斥关系,描绘出分子几何形状的全貌。虽然有它的局限性,但这一模型在化学研究与教育中依然扮演着不可或缺的角色。在未来,随着化学科学的不断发展,VSEPR模型有望与其他先进理论相结合,为理解分子结构及其反应提供更加全面的视角。无论是在实验室研究还是日常化学应用中,VSEPR模型都将继续为我们打开通向分子世界的大门。