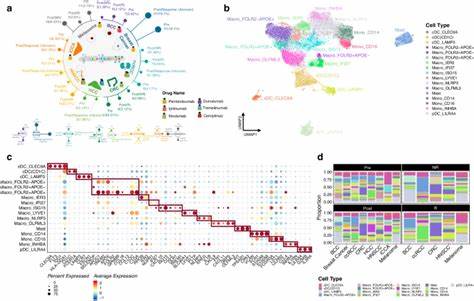
肿瘤微环境(Tumor Microenvironment,简称TME)作为癌症发生、发展和治疗反应的重要调控因素,近年来引起了广泛关注。TME是肿瘤细胞与其周围多种细胞类型及信号分子的复杂网络,包括免疫细胞、基质细胞、血管内皮细胞、成纤维细胞等。这些不同细胞群体之间的相互作用深刻影响肿瘤的生物学行为、转移潜能以及对治疗的耐药性。然而,由于肿瘤组织的高度异质性,传统的研究方法难以全面、准确地描绘整个微环境的细胞组成和动态变化。为解决这一难题,科学家们开发并整合了基于基因表达数据的多种解卷积算法,以期精细分辨肿瘤组织中的细胞成分及其功能状态,从而更好地理解肿瘤与宿主免疫系统和基质环境的复杂联系。最新发表于Scientific Reports期刊的一项研究,综合运用了九种不同的解卷积工具,对美国癌症基因组图谱(TCGA)中超过一万份肿瘤及邻近正常组织的转录组数据进行了细致分析,涵盖33种不同癌症类型。
该研究创建了包括79种免疫及基质细胞类型的综合细胞组成评分体系(iScore),为肿瘤微环境的复杂性提供了前所未有的全景式描绘。研究显示,免疫细胞群体的丰富程度及具体亚型的分布,显著区分了不同癌症类型的微环境结构,且与患者的临床预后密切相关。例如,包含高水平白细胞浸润的肿瘤通常表现出较好的预后,尤其在膀胱癌的特定分子亚型及黑色素瘤的RAS热点突变亚型中表现尤为明显。该研究进一步揭示了免疫细胞与基质细胞之间复杂的相互作用关系。比如,肿瘤相关成纤维细胞(CAF)在某些癌种如肾细胞癌中与患者预后负相关,同时这些基质细胞组分与免疫浸润的程度存在一定关联,提示免疫与基质的共调控在肿瘤进展中的作用。值得注意的是,该研究应用了整合方法,将多种解卷积工具的输出结果结合为统一评分,相较单一工具具有更高的准确性和稳定性。
通过构建细胞组成的降维图谱,聚类分析揭示了41个不同的肿瘤微环境亚群,不仅反映不同癌种的内在异质性,也展示了肿瘤亚型内部的免疫微环境差异。例如,膀胱癌的免疫富集亚群表现出更高的突变负荷和更佳的生存率,突显了肿瘤免疫环境在患者治疗策略选择中的潜在价值。基因突变对肿瘤微环境的塑造同样引人关注。研究发现部分驱动基因突变如CASP8与增强的免疫细胞浸润正相关,而NRAS突变则与免疫细胞的广泛排斥相关,暗示突变型肿瘤可通过逃避免疫监视机制实现生存优势。此外,膀胱癌中的FGFR3特定突变与免疫抑制状态有关,为分子靶向治疗与免疫治疗的结合提供了新的思路。免疫浸润程度已被视为免疫检查点抑制剂疗效的重要生物标志,但该研究指出,肿瘤突变负荷(Tumor Mutation Burden,TMB)与免疫细胞丰度的关系并非完全一致,具体相关性依赖于癌种背景,提示TMB作为免疫治疗预测指标的局限性。
综合来看,这项跨癌种的整体解卷积分析不仅深化了对肿瘤免疫和基质组成多样性的认识,同时揭示了肿瘤基因组变异与微环境免疫调控之间复杂的互作网络。该方法的广泛应用有望推动精准免疫治疗方案的设计,促进免疫治疗响应率的提升。未来,结合更高分辨率的单细胞测序及空间组学技术,进一步验证与拓展此类综合解卷积策略,将有助于揭示肿瘤微环境的时空动态,优化患者分层,实现个性化医疗。总之,跨癌种肿瘤微环境解卷积研究为我们揭示不同肿瘤类型内的免疫与基质细胞异质性、分子驱动突变与细胞浸润的相关共性特征提供了宝贵数据资源和分析框架,对于深入理解肿瘤免疫逃逸机制、发现新的治疗靶点具有重要意义。这不仅推动了基础肿瘤生物学的研究进步,也为临床制定更精准的免疫治疗策略奠定了坚实基础,助力实现癌症患者的长期生存和治愈目标。