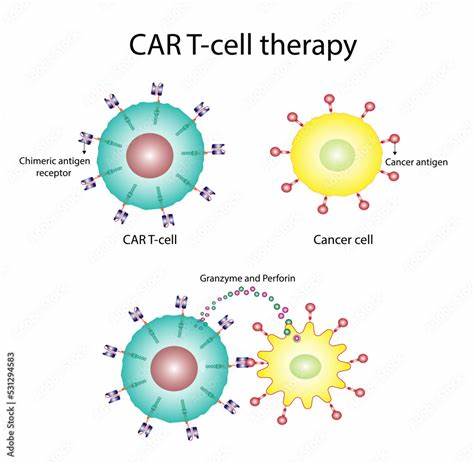
癌症作为全球致死率最高的疾病之一,一直是医学界攻坚克难的重点。近年来,免疫疗法,尤其是以T细胞为核心的治疗策略,成为抗癌研究的热点。T细胞因其特有的免疫识别和杀伤功能,被誉为人体免疫系统中的“战士”。然而,如何有效提升T细胞对癌细胞的识别能力,长期以来都是科学家们面临的挑战。随着人工智能(AI)技术的高速发展,科学家们利用AI生成的新型蛋白——“迷你结合蛋白”(minibinder),成功提高了T细胞对癌细胞的识别和杀伤能力,推动癌症免疫治疗迈入了一个崭新的时代。传统上,T细胞通过其表面的T细胞受体(TCR)识别并结合主要组织相容性复合体(MHC)上呈现的癌细胞抗原,以触发免疫反应。
这一过程至关重要,但天然TCR对某些癌症抗原的亲和力有限,使得T细胞难以有效清除癌细胞。传统的方法设计和筛选高亲和力的TCR蛋白耗时长,成本高,且难以进行高通量筛选。为解决这一难题,丹麦技术大学的免疫学家Hadrup及数据科学家Jenkins团队借助先进的机器学习平台,突破性地设计出了能够高度特异结合目标癌症抗原的蛋白质迷你结合蛋白。这些蛋白是完全从零开始(de novo)设计的,基于已知的MHC-抗原晶体结构,AI自动生成具备理想结合特性的蛋白质序列和三维结构。如此创新的设计,不仅大幅缩短了发现周期,从以往的近两年缩短到数周内即可完成,还能针对传统方法无法接触的复杂靶点进行有效设计。团队以NY-ESO-1——一种具有代表性的癌症相关抗原作为试点靶点进行实验。
NY-ESO-1因其结构清晰且在多种肿瘤中高表达,成为癌症免疫靶点的理想模型。AI设计出的迷你结合蛋白与MHC-呈递的NY-ESO-1抗原高度结合,在体外实验中,表达此迷你结合蛋白的T细胞显示出更强烈而精准的杀伤能力,明显优于未经过改造的普通T细胞。此次研究不仅通过AlphaFold2等深度学习工具预测了蛋白结合特性,还通过冷冻电镜技术验证了实际蛋白结构与预测模型的高度吻合,彰显了AI辅助蛋白设计的可靠性和精准性。更令人振奋的是,这种AI平台还成功应用于结构尚未知晓的转移性黑色素瘤新抗原,设计出几种高亲和力的迷你结合蛋白,展示出极高的通用性和潜力。人工智能在蛋白质设计领域的崭露头角,不仅源于近年来机器学习在结构生物学和计算生物学的革命性进展,还得益于新一代高性能计算和深度神经网络。一些专家指出,这一技术有望彻底重塑癌症免疫治疗的研发流程,将高效、个性化治疗选择带给更多患者。
AI设计的迷你结合蛋白不仅结构上与天然TCR截然不同,展现出前所未有的多样性,也避免了传统蛋白工艺中的一些限制,如蛋白稳定性和免疫原性的风险。此外,该技术不仅适用于癌症免疫,也具备阻断MHC与T细胞异常结合以治疗自身免疫疾病的潜力,广泛开拓了应用前景。随着后续研究的深入,科学家们正致力于将这些创新蛋白转化为临床级产品,进行临床试验验证其安全性和有效性。AI驱动的蛋白设计有望实现个体化定制,针对不同癌症患者的特定抗原快速生成专属治疗蛋白,推动精准医疗的发展。与此同时,探索AI与其他新兴技术的结合,如基因编辑、单细胞测序和空间组学,将进一步深化对肿瘤免疫微环境的理解和干预能力。面对癌症的复杂性和多样性,传统治疗手段单靠药物或单一免疫策略往往难以取得最佳疗效。
人工智能辅助设计的蛋白质为多模态治疗提供了创新工具,能够与现有免疫检查点抑制剂、细胞疗法联用,发挥更强的协同效应。未来,随着算法优化与结构预测精度提升,这一领域将涌现更多高效的新型免疫调节蛋白,为患者带来更安全、有效且个性化的抗癌方案。人工智能技术与生命科学的深度融合,无疑为破解癌症难题开辟了新路径。迷你结合蛋白的成功示范不仅证明了计算生物学的巨大潜力,也昭示着人类对抗癌症的信心和决心。在不久的将来,依托于AI生成蛋白的T细胞疗法有望成为临床常规手段,造福广大患者,书写癌症治疗新篇章。