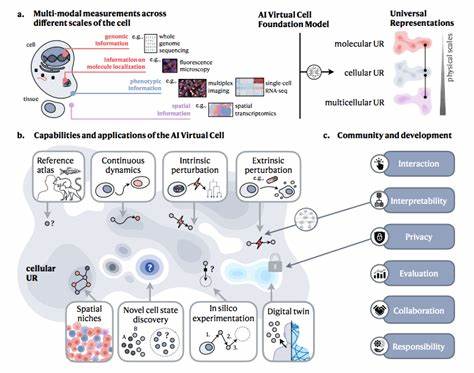
近年来,虚拟细胞的概念在生物医学领域内备受关注。虚拟细胞被定义为一种能够模拟细胞及其系统在不同条件和环境下行为的计算模型,它涵盖细胞的分化状态、扰动反应、疾病发展以及随机生物学波动等多方面特性。借助先进的机器学习技术,虚拟细胞旨在整合跨层级、跨时间以及多模态的生物学数据,逐步揭示细胞系统的内在编程语言,为生物医学研究和治疗方案设计提供创新的计算工具。尤其是在癌症研究领域,虚拟细胞的应用展现出巨大的潜力。癌症作为一个极其复杂的细胞生态系统,其复杂的异质性和微环境特征使得传统研究面临诸多挑战。虚拟细胞模型则通过模拟肿瘤微环境及肿瘤细胞与免疫细胞的相互作用,为深度理解癌症生物学及治疗反应提供了强大的支持。
构建有效的虚拟细胞模型,最核心的一步是拥有丰厚的高质量数据作为训练基础。Noetik公司通过收集超过7700万个细胞、来自2500多名患者、涉及十多个癌症类型的肿瘤切除样本,结合空间转录组学、空间蛋白质组学、外显子测序及H&E染色图像,积累了一套规模空前的真实人体肿瘤数据集。这种独树一帜的全部基于人类组织的训练数据,极大增强了模型结果向临床可翻译性的紧密联系。相较于依赖传统癌症细胞系及动物模型,虚拟细胞能更真实地揭示人体内的生物学机制,从而有效减少"模型与现实脱节"带来的翻译失败风险。虚拟细胞的应用在癌症药物开发尤其是在临床阶段展现出独特优势。临床试验通常耗时长、成本高,且风险极大,尤其在患者选择和疗效预测方面存在显著瓶颈。
Noetik开发的虚拟细胞模型OCTO-VC,能够根据邻近细胞的转录组信息,准确重构中心细胞的转录状态,进而通过无监督的嵌入分析,识别患者肿瘤中潜在的反应者亚群。对于抗PD-1疗法,这一模型能够进一步细分传统的PD-L1阳性患者群体,识别出更有可能响应免疫检查点阻断治疗的个体。该模型的嵌入空间充分展现出临床意义,甚至超过了现有基于单一标记物(如PD-L1表达比例)的诊断标准,更精准地区分了响应者与非响应者,这在实际临床决策中具有重要指导价值。除了精准识别抗PD-1反应者,虚拟细胞还可以优化临床试验的患者纳入标准。多年来,癌症临床试验往往依赖几十年前制定的粗糙生物标志物,诸如单一基因突变、蛋白表达水平等,来简单划分患者群体。尽管复杂且多维度的生物学数据早已存在,现实中缺乏高效、快速且经济可行的方法去设计和验证复杂的多标志物筛选方案。
OCTO-VC通过分析大规模真实人类肿瘤数据集,以机器学习挖掘出潜在且精准的患者亚群,能超越传统限制,推荐更科学和细致的纳入标准,最大化疗效同时扩大受益患者范围。更令人振奋的是,该方法不依赖事先的数据标签或预先假设,完全通过无监督学习揭示药物作用机制相关的生物学特征,为重大临床应用铺平了道路。在药物靶点的发现与验证方面,虚拟细胞同样发挥着巨大作用。以非小细胞肺癌中的KRAS和STK11突变共现为例,STK11突变使得肿瘤免疫环境更加"冷",降低免疫疗法的效果。OCTO-VC利用虚拟CD8⁺T细胞模拟技术,揭示了这两类肿瘤在关键杀伤性蛋白酶(如GZMA、GZMK)的表达差异,为理解免疫效应细胞功能提供了新的视角。传统上,这样的研究大多依赖于动物模型或体外细胞实验,但跨物种的免疫机制差异使得结果难以直接翻译到临床。
通过对人类肿瘤微环境的虚拟扰动模拟,OCTO-VC可以在计算机上"敲除"一个个基因,观察CD8⁺T细胞的响应变化,进而筛选出潜在靶点。实验证明,针对一个名为Target A的细胞粘附蛋白的干预能够提升T细胞中颗粒酶的表达,具有诱导免疫效应活性的潜力。更关键的是,临床前期的药物试验中对Target A的患者筛选未结合KRAS与STK11联合突变信息,导致疗效评价受限,未来结合虚拟细胞模型提供的精准分层,有望显著提升药物研发的成功率。虚拟细胞模型所带来的不仅是数据解析层面的突破,更是一种全新的药物开发范式。它通过真实人体数据直接构建模型,缩短了从预临床到临床的转化链条,有效降低开发风险,同时以较低的成本和更快的速度筛选最佳患者人群和治疗策略。随着空间组学和多组学技术的发展,虚拟细胞的精度和广度将持续增强,未来将逐步扩展到更多疾病领域和生物医学场景。
总之,虚拟细胞为癌症药物开发开启了一条崭新的道路。通过基于海量人体肿瘤数据的精准模拟,它帮助科学家识别患者反应特征、优化临床试验设计并发掘靶点,直击药物开发中的核心难题。虽然虚拟细胞研究尚处于早期阶段,但其应用实践已展现出关键的价值与潜力。未来,随着技术的进步和数据的积累,虚拟细胞必将成为生物医学领域不可或缺的重要工具,加速实现个性化与精准医疗的目标,让更多患者获得最有效的治疗方案,最终改变癌症治疗的整体格局。 。