人类免疫缺陷病毒(HIV)感染虽经过抗逆转录病毒治疗(ART)已取得极大进展,但病毒的潜伏状态仍是阻碍治愈的主要障碍。潜伏的病毒整合入宿主静息CD4+ T细胞基因组中,处于转录沉默状态,常规治疗难以清除。现有治疗方法难以完全激活并清除这一病毒库,促使科学家探索高效、特异的潜伏激活策略。近期,基于mRNA传递的新技术为实现对静息T细胞的高效基因表达打开了新的可能性,进而推动潜伏逆转领域的突破。传统药物激活潜伏病毒的方法多使用小分子化合物,虽然可诱导部分HIV转录启动,但大多数存在激活效应有限、非特异性和毒副作用等问题。此外,这类化合物无法充分克服转录延伸及剪接等多重阻断,因而未能有效减少潜伏病毒库规模。
针对这些瓶颈,科研团队研发了一款创新型脂质纳米颗粒(LNP X)配方,结合mRNA技术,实现无须预刺激即可高效转染难以转染的静息CD4+ T细胞。该新型LNP基于替换传统离子化脂质和胆固醇类组分,采用SM-102与β-谷甾醇配比,显著提升颗粒与细胞的结合及胞质内RNA转译效率,且细胞毒性低。这一突破实现了高达75%以上的转染效率,开创了非活化条件下靶向T细胞表达外源蛋白的新纪元。实验证明,封装有编码HIV转录激活蛋白Tat的mRNA的LNP X(Tat-LNP X),在J-Lat潜伏病毒细胞系中可快速激活HIV长端重复序列(LTR)介导的转录活性,触发病毒基因表达,体现了强大的潜伏逆转能力。更为重要的是,该技术在来自接受ART治疗的HIV患者的体外静息CD4+ T细胞样本中同样展现出显著的激活效果。Tat-LNP X能够有效克服转录延伸、完成及剪接等多个转录调控点,诱导病毒RNA及多种剪接产物大量表达,远超传统的免疫激活剂如PMA/PHA的能力,而不会引起T细胞非特异性激活。
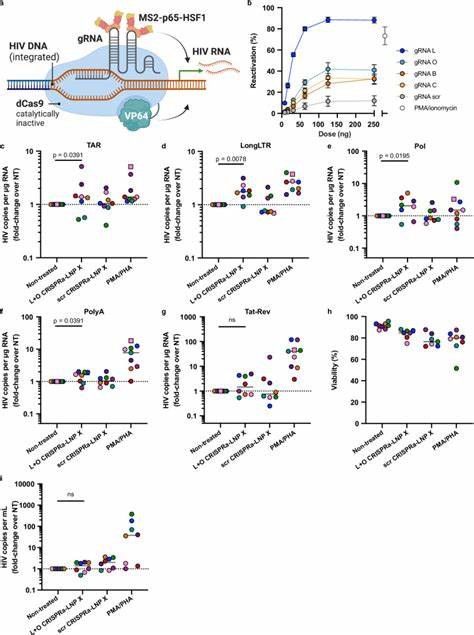
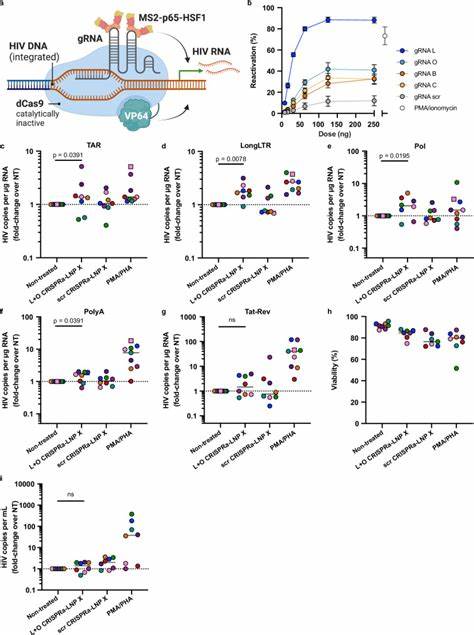
这意味着能以更低副作用,更精确地激活潜伏病毒,从而为“shock and kill”策略提供了新的突破口。此外,Tat-LNP X处理后,在细胞培养上清液中检测到病毒RNA增加,提示有效诱导病毒生产,但尚未见病毒感染细胞数量下降,提示潜伏病毒细胞清除仍需结合其他干预措施如增强免疫清除或诱导感染细胞凋亡。此研究不仅局限于Tat蛋白,创新型LNP X平台还支持更复杂的基因编辑工具的递送。研究人员成功将CRISPR激活系统(dCas9-SAM)及靶向HIV LTR的导向RNA封装入LNP X中,实现了对潜伏病毒启动子的精准激活。该CRISPRa-LNP X在初代静息CD4+ T细胞中引起靶向基因如CD25的显著表达提升,证明其强大的基因调控能力与递送性能。相较于Tat-LNP X,CRISPRa-LNP X在激活HIV转录方面虽然效率稍逊,但仍明显优于无治疗组,且未观察到细胞激活或毒性增加。
这种高特异性基因激活技术为未来基因编辑甚至切除整合HIV基因组提供理想载体。关于作用机理,研究揭示LNP X的优越表现主要来自增强的细胞结合性及mRNA的高效翻译能力,而非简单的内吞及内体逃逸步骤改进。此外,LNP X显示对多种T细胞亚群及其他免疫细胞具转染能力,尽管非专一,但通过结合针对性配体,可进一步实现靶向递送。面向临床转化,LNP X载体的低毒性和优异细胞转染效率表明其在体内应用前景广阔。不过未来仍需深入评估其体内分布、免疫原性及药代动力学特征,以及探讨可行的靶向递送策略。结合LNP X载体,mRNA疗法有潜力扩展至多种免疫调节和基因治疗范畴,尤其对解决HIV潜伏病毒库治理难题具划时代意义。
总结来看,新一代基于LNP X的mRNA传递平台成功攻克了静息T细胞难以转染的技术壁垒,实现精准、高效、低毒的HIV潜伏期逆转。Tat蛋白与CRISPRa系统的有效递送开启了HIV治疗策略升级的可能,不仅提升了潜伏病毒激活的强度与特异性,也减少了对T细胞激活相关副作用的依赖。未来结合病毒感染细胞的免疫清除措施可能实现更有效的病毒库缩减。此外,LNP X平台可广泛适用于其它基因调控及治疗需求,助力免疫细胞基因功能研究及临床疗法研发。随着进一步体内安全性及功效验证,基于LNP X的mRNA治疗有望成为HIV功能治愈及免疫治疗领域的核心技术突破。科学界亟需关注该技术在临床转化过程中的优化与整合,为攻克HIV潜伏病毒提供新武器,同时拓展mRNA纳米递送系统于多领域精准医疗的应用前景。
。