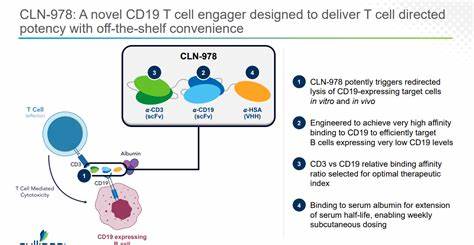
《Cullinan Therapeutics获批启动全球I期临床试验,CLN-978旨在治疗系统性红斑狼疮》 2024年9月17日,生物制药公司Cullinan Therapeutics, Inc.(纳斯达克股票代码:CGEM)宣布,已获得澳大利亚人类研究伦理委员会(HREC)的批准,启动其全球I期临床试验,以评估CLN-978这一新型治疗系统性红斑狼疮(SLE)的药物。此次试验的开展标志着公司在针对自身免疫性疾病的研究中迈出了重要一步,也为全球范围内数以万计的SLE患者带来了新的希望。 系统性红斑狼疮是一种复杂的自身免疫性疾病,全球大约有43万人受到其影响。该疾病的特点是免疫系统错误地攻击健康组织,导致严重的健康问题,包括皮肤损伤、关节炎、肾脏问题等。当前的治疗手段大多主要依赖于免疫抑制疗法,患者通常需要终身服药以控制症状,然而这些治疗方法并不能改变病程,也难以实现治疗后的持续缓解。 CLN-978是一种新型的CD19xCD3双特异性T细胞引导剂,旨在通过精确靶向CD19阳性的B细胞来激活患者的免疫系统,从而实现更有效的治疗。
相较于传统的治疗方法,CLN-978的设计理念在于提供一种“随用随取”的治疗方案,减少患者的用药负担,提高治疗的可及性。 Cullinan Therapeutics的首席医学官杰弗里·琼斯(Jeffrey Jones, MD, MBA)表示:“我们很高兴能获得这一重要批准,标志着我们全球临床试验的启动。CLN-978的研发结合了最佳的靶点(CD19)和治疗模式(T细胞引导剂),在治疗系统性红斑狼疮方面有着显著的差异化潜力。我们期待与全球各地的研究中心、临床调查员及患者合作,加快CLN-978的开发进程。” 此次I期临床试验的主要目标是评估CLN-978的安全性、药代动力学特征及初步的临床疗效。研究团队将在澳大利亚及其他国家的多家医疗中心开展试验,这也彰显了Cullinan Therapeutics在全球化临床研究布局方面的雄心。
CLN-978作为一种最新研发的药物,其工作机制是通过靶向B细胞表面的CD19抗原和T细胞表面的CD3受体,介导T细胞的活化与增殖,从而对病理性B细胞进行清除。这种双特异性的特征使得CLN-978在治疗自体免疫疾病时可能展现出更高的靶向性和更低的副作用。 在现有治疗手段中,大多数治疗药物并不能确保患者的长期缓解,且许多患者面临与副作用和并发症相关的风险。因此,CLN-978的研发被寄予厚望。专家分析认为,这种新型的T细胞引导剂有潜力改变SLE的治疗策略,从而改善患者的生活质量。 与此同时,Cullinan Therapeutics还于9月16日向美国食品药品监督管理局(FDA)提交了新药临床试验申请(IND),希望在美国地区也能尽快开展CLN-978的临床试验。
这一举动显示出公司在加速推进全球临床开发战略方面的决心。 系统性红斑狼疮不仅是一种医学挑战,更是一个社会问题。该疾病的发病率在女性,尤其是育龄女性中相对较高,同时,这一进程的复杂性导致很多患者面临长时间的医疗负担和心理压力。CLN-978的成功研发与推出,将有望帮助这些患者摆脱长期治疗的枷锁,提高他们的生活质量。 在Cullinan Therapeutics的长期愿景中,成立之初便致力于开发针对多种自身免疫疾病和癌症的标志性疗法。其多元化的临床资产组合涵盖了针对多种疾病机制的治疗方案,目标是通过创新科技提供更有效的治疗选择。
随着临床试验的逐步推进,公众对CLN-978的关注度不断上升。不少患者及其家属纷纷表示对这项新药物的期许,盼望它能带来新的治疗曙光。 在接下来的日子里,Cullinan Therapeutics将全力以赴,确保临床试验的顺利进行,充分评估CLN-978的各项指标,力求为患者带来更为有效和安全的治疗方案。同时,公司还将与各界保持密切沟通,跟进试验进度,并积极回应社会各界的关切,以透明的态度推动科学研究的进展。 综上所述,Cullinan Therapeutics在全球范围内启动CLN-978的I期临床试验,不仅体现了该公司在治疗自身免疫性疾病领域的持续努力与创新,也为系统性红斑狼疮患者带来了新的希望。未来的临床结果令人期待,生物制药行业的这一创新脚步必将推动医疗科技的进步与发展。
。