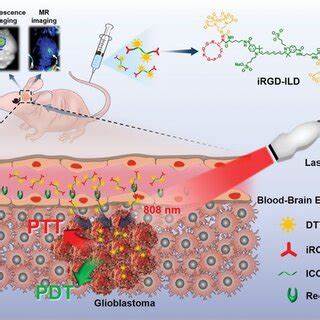
胶质母细胞瘤作为最常见且恶性程度最高的脑部肿瘤之一,因其侵袭性强、边界模糊,给外科手术带来了极大挑战。完全切除肿瘤组织同时避免伤及正常脑组织,是决定患者预后和生存质量的关键。然而,传统的视觉及手感定位肿瘤的方法存在局限,术中肿瘤边缘难以精准区分,导致术后复发率高。近年来,影像引导手术技术日益被重视,借助特异性的分子探针实现肿瘤实时可视化,提升手术精准度,成为神经肿瘤外科的重要研究方向。脂肪酸代谢的特殊性为研发新型探针提供了契机。脂肪酸不仅是肿瘤细胞的主要能量来源,还参与细胞膜构建和信号转导,其摄取和代谢在多种癌症,尤其是胶质母细胞瘤中被显著上调。
利用这一代谢特征,科学家们设计了一种创新的近红外脂肪酸分子探针(FA-ICG),通过脂肪酸与近红外染料吲哚菁绿(ICG)的共价连接,实现对脂肪酸代谢活跃肿瘤的靶向标记。该探针不仅结合了ICG的深组织穿透能力和低自发荧光优势,还利用脂肪酸的生理运输路径,保证探针的特异性摄取和长期滞留。近红外光学成像的高灵敏度以及非放射性特点,使其在临床手术现场具备极佳的实时监测能力。体外实验显示,FA-ICG探针在脂肪细胞和多种癌细胞系中均有明显摄取,且该过程可被自然脂肪酸竞争抑制,验证了探针的生理相关性。特别是在胶质母细胞瘤细胞系U87-MG中的显著摄取,为其后续的动物模型研究奠定了基础。在动物体内模型中,经过静脉注射的FA-ICG探针能在脑部肿瘤区域实现清晰的荧光成像,信号强度明显高于对照组自由ICG染料,且在术中手术显微镜下能够实时显示肿瘤边界,实现手术精准切除。
更重要的是,这种探针在患者来源的异种移植模型中同样表现出优良的成像效果,有助于研究肿瘤异质性及更贴近临床的应用场景。此外,FA-ICG在伴侣动物如犬类肿瘤中的应用也展现了良好的成像和手术导航潜力,强调了其跨物种的广泛适用性。相比现有的肿瘤荧光探针,如5-氨基乙酰丙酸(5-ALA),FA-ICG具有无须暗室操作、低光漂白、穿透深度大以及更高的肿瘤特异性等优势。5-ALA依赖代谢生成的原卟啉IX发射较短波长荧光,受限于组织吸收和散射,影像对比有限。自由ICG虽被广泛使用,但其在血液中的短半衰期导致非特异性信号较高,而FA-ICG则通过脂肪酸运输机制实现了更持久且特异的肿瘤累积。影像引导手术的发展不仅提升了切除肿瘤的完整性,同时降低对健康组织的损害,改善患者术后神经功能。
FA-ICG的创新设计融入了代谢靶向性与临床成熟染料,具有很强的转化潜力。未来,该探针有望整合进神经外科多模态成像平台,结合MRI和术中超声,实现多维度精准导航。与此同时,基于该平台开发的脂肪酸代谢相关治疗策略亦值得期待,可为胶质母细胞瘤患者提供个性化精准医疗的新途径。随着配套成像设备的不断进步和临床试验的推进,FA-ICG探针的安全性、稳定性以及药代动力学将得到系统评估,推动其临床审批和广泛应用。综上所述,FA-ICG代表着胶质母细胞瘤术中影像引导领域的重大创新。通过高灵敏度的近红外脂肪酸标记手段,该技术不仅实现了肿瘤组织的精确定位,还为实现最大限度肿瘤切除和保护正常脑功能提供了可能,彰显了代谢导向成像探针在精准肿瘤外科的大有作为。
随着科研的不断深入和多中心临床研究展开,近红外脂肪酸分子探针有望引领脑肿瘤手术一场革命,助力无数患者赢得生命的新希望和更美好的未来。