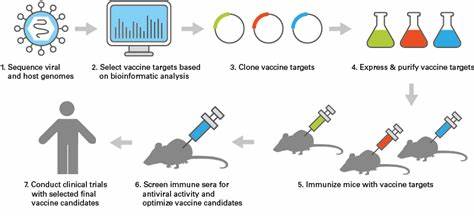
疫苗作为公共卫生的基石,极大地改善了人类健康水平。然而,针对病毒的疫苗研发过程依然充满挑战,尤其是许多病毒的复杂多样性和培养难度,使得快速设计和生产有效疫苗成为一项艰巨任务。最近,一项来自麻省理工学院和哈佛大学布罗德研究所的突破性研究提出了一种名为大规模平行核糖体测序(Massively Parallel Ribosome Profiling,简称MPRP)的新技术,旨在快速而安全地揭示病毒蛋白质的表达谱,从而推动疫苗研发的新时代。 传统的病毒研究依赖于实验室培养病毒样本,这不仅耗时长且要求高等级的安全防护设施,对高度致病性病毒而言尤为如此。多数病毒甚至无法在实验室条件下有效培养,导致它们的蛋白质表达特征难以被准确识别和理解。此外,病毒基因组具有巨大多样性,单一病毒的不同变异体之间可能存在显著差异,这进一步提高了进行并行多病毒研究的难度。
MPRP技术的出现正是在这样的背景下应运而生,它提供了一种无需培养活体病毒即可高通量解析病毒蛋白翻译的创新方法。 MPRP技术的核心理念是通过合成病毒基因组的成千上万个短片段,并将它们克隆入质粒载体中后转染入人体细胞。如此一来,研究人员不再直接处理病毒本身,而是在安全的细胞模型中观察由病毒DNA编码的蛋白质合成过程。随后,借助高通量测序技术,团队能够精准定位活跃翻译区即核糖体结合在mRNA上的位置,从而识别出病毒基因组中哪些开放阅读框(Open Reading Frames,ORFs)被细胞正在翻译为蛋白质。值得一提的是,该方法不仅揭示了病毒的传统蛋白,还发现了大量此前未被注释的非经典ORFs,这些非经典区域可能编码着短肽或使用非典型的起始密码子,极大地丰富了我们对病毒蛋白质组的认知。 此次研究共识别出超过4200个未被注释的开放阅读框,覆盖了679种与人类相关的病毒基因组。
这一庞大的新发现极大地扩展了已知病毒蛋白的范围,为疫苗设计提供了新的靶点。尤其重要的是,研究团队发现部分非经典ORFs编码的病毒肽段能够通过I类人类白细胞抗原(HLA)分子呈递给免疫细胞,这对于免疫系统识别和诱导有效的免疫反应至关重要。这意味着这些新发现的蛋白质片段有潜力成为开发新型疫苗或者抗病毒治疗的关键成分。 此外,MPRP还能检测到众多上游开放阅读框(upstream ORFs,uORFs),它们通常位于传统蛋白编码区启动子上游,可能在病毒蛋白质翻译调控中发挥重要作用。这些uORFs尚未被充分研究,但其机制和功能值得深入探讨,有望为病毒生物学和免疫学研究开辟新路径。 疫苗设计中的一个重大难题是应对病毒的遗传变异,使疫苗对多种病毒变异株均具备广泛保护能力。
MPRP的病毒无关特性和高通量能力使其能够同时对大量病毒样本进行蛋白质组学分析,快速识别出所有可能表达的蛋白质,包括罕见变异型蛋白。这极大提升了疫苗开发的效率和精准性,有助于加快应对新兴病毒和变异病毒的公共卫生反应速度。 在细胞条件和环境因素变化下,病毒的蛋白表达谱也可能发生变化。MPRP平台的多样化可调节能力使研究人员能够模拟不同的细胞环境和应激条件,全面剖析病毒蛋白翻译的动态变化。这对于理解病毒如何在不同宿主细胞中适应和逃避免疫系统检测意义重大,也为开发更为有效的疫苗策略提供依据。 值得关注的是,虽然MPRP揭示了大量潜在的候选ORFs,但这些区域的具体翻译产物功能及其在病毒生命周期中的角色仍需深入研究。
未来的工作可能涉及结合蛋白质组学、结构生物学和免疫学方法,系统解析这些新蛋白的结构、功能和免疫原性,从而为疫苗和抗病毒药物的设计提供科学基础。 MPRP的出现不仅为病毒学和疫苗研发带来了技术革新,还具备广泛的应用前景。它的可扩展性和通用性意味着该方法可以推广至其他病毒类别的研究,甚至应用于研究细菌和其他病原体的蛋白质翻译过程。更广泛地看,MPRP技术也有助于推动精准医疗的发展,为个性化疫苗设计和靶向治疗开辟了新道路。 总之,大规模平行核糖体测序作为一种革命性的病毒蛋白表达分析工具,正引领疫苗研发迈入一个崭新的时代。它通过克服传统病毒培养的限制,实现了对病毒蛋白组的全面、高效探索,为疫苗设计提供了丰富而精准的靶点资源。
随着对未注释蛋白功能理解的逐步加深,未来的疫苗和抗病毒策略将更加科学和高效,从而更好地保护人类免受病毒威胁。