胰腺癌作为世界范围内死亡率极高的恶性肿瘤之一,其诊断晚、侵袭性强及对传统治疗方案耐药性高的特点,使其成为全球公共健康的重大挑战。当前,针对胰腺癌的有效治疗手段仍然有限,因此开发安全高效的天然抗癌药物迫在眉睫。甜叶菊(Stevia rebaudiana Bertoni)不仅以其天然甜味成分闻名,更因其丰富的黄酮类和酚类化合物被广泛研究为多种疾病的辅助治疗资源。随着微生物发酵技术的进步,人们逐渐认识到乳酸菌发酵能够显著转化和提升植物有效成分的生物活性,尤其是在抗癌领域显示出巨大潜力。近期,利用植物源乳酸菌Lactobacillus plantarum SN13T发酵甜叶菊叶提取物,针对胰腺癌PANC-1细胞的研究揭示了一种新颖有效的天然抗癌策略。 发酵甜叶菊提取物(简称FSLE)在抗氧化能力方面表现尤为突出。
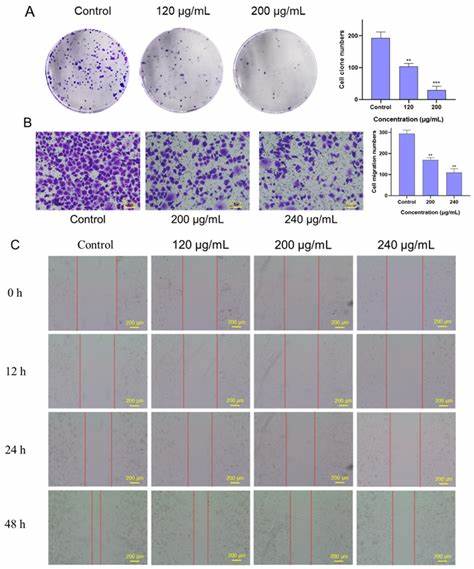
通过DPPH和ABTS自由基清除实验,以及H2O2诱导的氧化损伤修复细胞模型观察,FSLE显示出显著优于未发酵提取物(SLE)的抗氧化性能。强大的抗氧化能力不仅有助于减轻癌细胞氧化应激诱导的DNA损伤,也为其后续细胞毒性作用奠定基础。值得注意的是,FSLE对人体非癌变细胞HEK-293具有较低的毒副作用,体现出良好的选择性毒性,增加其临床应用的安全性。 进一步细胞学检测显示,FSLE可以显著抑制PANC-1细胞的增殖和迁移能力。克隆形成实验表明,FSLE处理组的细胞集落数目随着浓度上升而明显减少,证明其对癌细胞增殖具抑制作用。同时,伤口愈合及Transwell迁移实验结果证实,FSLE明显阻断了胰腺癌细胞的迁移过程,提示其在抗转移方面潜力巨大。
分子层面上,FSLE有效上调了细胞黏附分子E-cadherin的表达,进一步支持了其抗癌转移机制。 通过高效液相色谱(HPLC)联用质谱和核磁共振技术的精密分析,FSLE中主要活性成分被鉴定为氯原酸甲酯(Chlorogenic Acid Methyl Ester,CAME)。研究发现,未发酵的甜叶菊提取物中主要存在氯原酸(Chlorogenic Acid,CA),而发酵后CA浓度显著降低,伴随着CAME的高浓度产生。这说明在乳酸菌的催化作用下,CA被甲基化转化为CAME,结构上的甲基化修饰显著提升了其细胞穿透性和稳定性,增强了其生物活性。 体外实验中,纯化的CAME对PANC-1细胞展现出浓度依赖性的细胞毒性作用,IC50值明显优于CA。流式细胞术分析进一步揭示,CAME能够诱导PANC-1细胞周期停滞于G0/G1期,从而抑制细胞增殖。
同时,CAME还显著促进细胞凋亡,其凋亡率随处理时间延长明显上升。 在分子机制研究中,CAME显著调控关键凋亡调节基因的表达。作为促凋亡因子的Bax和Bad mRNA水平明显上升,而抗凋亡基因Bcl-2表达下调,细胞内促凋亡信号增强。此外,细胞色素c(Cytochrome c)、半胱天冬酶-3(Caspase-3)和半胱天冬酶-9(Caspase-9)等线粒体内源性凋亡路径核心分子的表达量亦显著提升,提示CAME通过激活线粒体依赖的内源性凋亡途径促使胰腺癌细胞程序性死亡。 微生物发酵技术在提升植物源活性成分生物利用度方面的优势日益凸显。本研究中,L. plantarum SN13T通过其独特的酶系,实现了氯原酸向氯原酸甲酯的精准生物转化,不仅丰富了甜叶菊的抗癌成分谱系,更增强了其治疗前景。
这种绿色环保、无化学添加的发酵过程,为传统草本药物开发天然新药提供了有效范例。 总体来看,甜叶菊叶提取物经过L. plantarum SN13T发酵后,其对胰腺癌PANC-1细胞的抑制效果显著增强,表现出良好的抗增殖及抗迁移活性,并且副作用较低,具备高度选择性。致效成分CAME通过诱导细胞周期停滞及激活线粒体依赖的凋亡机制,实现了对胰腺癌细胞的细胞毒杀作用。这些发现为利用微生物发酵提升中草药抗癌效能开辟了新路径,也为胰腺癌的天然治疗剂研发提供了坚实的理论和实验依据。 未来的研究可以进一步探索CAME及FSLE在体内胰腺癌模型中的治疗效果及安全性评估,同时鉴定其他可能的协同活性成分,深化对其作用机制的理解。此外,加强发酵工艺的优化与规模化生产技术,推动其向临床应用转化,将有助于加速天然产物在癌症治疗领域的创新应用。
随着肿瘤治疗趋向多样化和个性化,结合益生菌发酵技术与中草药成分的研究模式,无疑将为癌症患者带来更加安全、高效的治疗选择。甜叶菊发酵提取物作为一个天然、低毒的抗胰腺癌候选药物,有望成为未来辅助治疗的重要突破口。