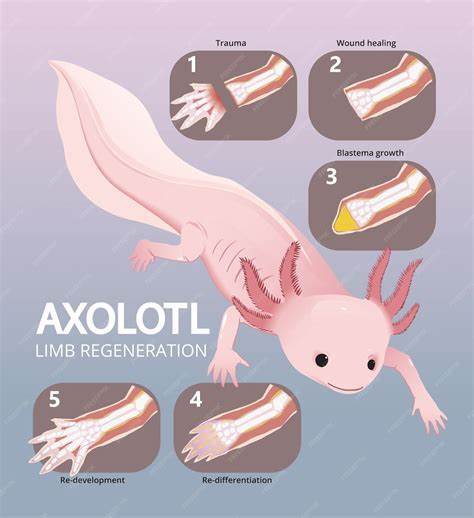
墨西哥钝口螈,这种长相永远年轻的神奇蝾螈,长期以来一直是生物医学领域的研究明星。它们不仅能够再生断肢,还能修复心脏损伤和脊髓缺损,展现出了超越常规生物学认知的再生“超能力”。然而,科学界多年来一直困惑于一个问题:断肢后的细胞如何准确判断自己的位置,决定是再生整个肢体还是一部分,如仅再生手部?这被称为“位置身份”之谜。近日,来自美国东北大学的詹姆斯·莫纳汉教授及其团队终于揭开了这道谜题的一角,他们的研究成果刊登在《自然通讯》杂志,指出控制关键分子降解速率是钝口螈实现肢体再生的关键所在。 莫纳汉实验室饲养着近五百只钝口螈,团队由本科生至博士后组成,始终潜心研究这一独特生物的再生机制。钝口螈虽然生长周期较长,但研究进展令人兴奋,因为团队总是在探索前所未有的生物学领域。
多年来,研究者们逐渐认识到神经系统在再生过程中的至关重要作用,以及钝口螈细胞的特殊性质,这些都令人对人类未来的再生医学充满期待。 陈旧观点认为,钝口螈断肢后的再生过程中,关键在于生物化学信号分子的产生,尤其是‘视黄酸’(即维生素A的衍生物)。视黄酸被证实是指导细胞生成从肩膀到指尖不同位置结构的重要信号分子。但直到莫纳汉团队的研究,科学家们才发现,真正关键的并非视黄酸的产生量,而是其被细胞降解的速度。 研究聚焦于肢体受伤部位形成的“胚芽”,这是一种由干细胞组成的结构,负责组织再生。不同于先前的假设,团队发现肢体远端,如手腕部位,含有大量一种名为CYP26B1的酶,该酶专门分解视黄酸,导致视黄酸浓度极低;而近端如肩部,CYP26B1含量极少,视黄酸能够积累并达高浓度。
视黄酸的梯度由此形成,成为细胞判断自身所处位置的“化学坐标系”。 为了验证这一发现,研究团队进行了一项创新实验:在钝口螈切断的腕部施用一种名为他洛唑(talarozole)的药物,它能够抑制CYP26B1酶的活性。结果令人惊讶,低位截肢的腕部因视黄酸降解受阻,其浓度异常升高,细胞误以为自己处于近端肩部区域,最终再生出完整的、甚至重复的肢体结构。这一“解除刹车”的实验,印证了视黄酸降解对肢体精准再生的核心作用。 更进一步,团队运用CRISPR基因编辑技术,精准敲除参与肩部发育的关键基因Shox(short stature homeobox gene),发现缺失该基因的钝口螈胚胎生成的肢体近端结构明显发育不全,使他们确认Shox是指挥肩臂骨骼形成的重要“指令基因”。这一发现说明再生不仅依赖信号分子梯度,还涉及复杂的基因程序,针对不同肢体部分激活不同基因。
这一研究不仅揭秘了钝口螈肢体再生的基础生物学机制,还为人类再生医学铺设了方向。人类体内虽然存在与视黄酸及Shox相关的基因,但我们缺乏钝口螈那种让细胞回归“胚胎发育状态”的能量,即所谓的“细胞去分化”能力。人类受伤后往往是形成不利于再生的瘢痕组织,而非促使细胞重获多能性的“胚芽”。如何诱导人体细胞形成类似钝口螈的“胚芽”,已成为医学界重要的科学难题。 莫纳汉教授提到,不必修改人类基因的DNA序列就能激活再生,只需在适当的时间和位置施加调控分子,重启受伤组织内基因的“发育程序”。未来基因编辑和干细胞技术可能实现这一点,使移植的干细胞能准确识别自身位置,从而实现完整肢体的结构性再生。
虽然实现人类完全肢体再生仍处于梦想阶段,但每一次类似关于视黄酸梯度与Shox基因作用的发现,都是向着实现这一目标稳步迈进的坚实步伐。研究人员期待有朝一日能开发出能够刺激人类细胞组装出复杂组织、修复重大损伤的疗法,甚至通过贴片或药物激活体内的再生程序,重塑受损肢体。 钝口螈作为科学研究的模型,经历了从百年前的辉煌到一度沉寂,再到现代基因编辑技术推动下的新一轮兴起。如今,它不仅是科研的重要对象,更成为文化象征,体现温柔与稀有的生命力量。随着分子生物学技术的进步,钝口螈为我们打开了探索生命再生奥秘的大门,也照亮了人类未来医学的光明前景。