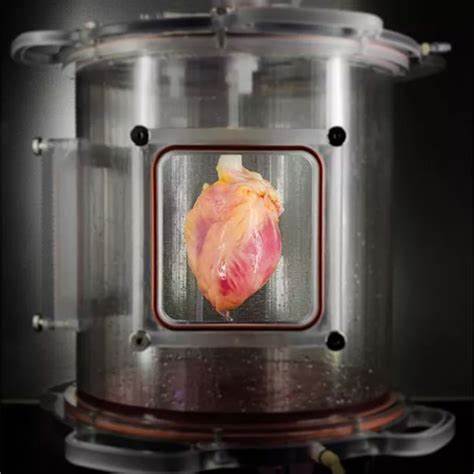
近年来,体外培养迷你器官(organoids)技术的迅速发展在生物医学领域引起了广泛关注。迷你心脏、肺和肝脏等器官模型因其在模拟人体结构及功能上的高度相似性,被视为研究人体发育机制和疾病模拟的理想平台。然而,长期以来,这些迷你器官模型都缺乏完整的组织结构,尤其是血管系统的缺失,限制了其功能的发挥和应用的广度。最近,科学家们在实验室成功培育出了能够自主生成血管网络的迷你心脏、肺和肝脏,为迷你器官研究揭开了崭新篇章。这一突破不仅提升了器官模型的复杂度和仿真度,也为药物筛选和个性化医疗开辟了更加精准的途径。实现自主血管生长的关键在于培养环境和细胞类型的创新。
研究团队优化了干细胞分化体系,引入了内皮细胞及血管支持细胞,使迷你器官内逐步形成微血管网络。这些血管不仅保证了器官内部细胞的养分供应,也起到了调节器官生理功能的作用,极大地增强了迷你器官的生理相关性和稳定性。血管系统的完善使得迷你心脏能够更加逼真地模拟心肌收缩和血液流动过程,迷你肺和肝脏在氧气交换和代谢功能上的表现也更加接近真实器官。科学家们通过显微成像和基因表达分析,确认血管网络结构复杂且功能活跃,显示出细胞间的良好通讯和协同工作,极大地提升了整体器官的生命力和应答能力。在疾病研究中,这些具备自主血管生成能力的迷你器官成为模拟心血管疾病、呼吸系统病变以及肝脏代谢异常等多种病理状态的理想模型。过去难以复制的血管病理过程,如动脉硬化、肺纤维化和肝脏纤维化等,都可以通过这些模型得到更深入的理解和实验验证。
同时,药物研发领域对这些迷你器官的需求也日益增长。具备真实血管系统的模型能够更准确地反映药物在人体内的分布、代谢和毒性,更有效评估新药的安全性和疗效。相比传统的二维细胞培养或单细胞模型,迷你器官在药物筛选上的优势显而易见,缩短了研发周期并降低了动物试验的依赖。此外,自主血管生成的迷你器官为个性化医疗带来了新机遇。通过利用患者自身的诱导多能干细胞(iPSCs)制造器官模型,可以更真实地再现患者的生理状况和疾病特点,实现针对性治疗方案的设计和测试。未来,随着技术的进一步提升,迷你器官甚至有望在器官移植领域发挥作用,解决器官供体不足的瓶颈。
尽管成就显著,但迷你器官的血管化仍面临诸多挑战。例如,如何实现更大规模的血管网络与外围组织的协调,保证器官长期稳定存活和功能发挥,是当前科研的重点方向。血管系统与免疫系统和神经系统的整合同样需要深入探讨,只有多系统相互作用的模型才能真正复制人体器官的复杂生理环境。与此同时,伦理和监管问题也随之浮现。实验室培育的组织和器官涉及干细胞及基因编辑等技术,需严格遵守相关法律法规和伦理准则,确保研究的合规性和安全性。此外,数据隐私保护和技术透明度亦是公众关注的焦点。
未来,跨学科合作将在推动迷你器官技术成熟和应用扩展中发挥核心作用。生物学家、材料学家、工程师和临床专家的联合攻关,将不断提升器官模型的结构复杂性和功能多样性。人工智能和大数据技术的引入,也将加快数据分析和模型优化的速度和精准度。综上所述,迷你心脏、肺和肝脏等器官的自主血管生成代表了再生医学和组织工程的重大进展。这些高度仿真的微型器官不仅为基础生命科学研究提供了强有力工具,也为人类疾病治疗和药物开发开辟了崭新路径。随着相关技术的不断成熟和完善,未来有望出现更加复杂、功能完整的人工器官,推动医学进入一个崭新的时代。
。