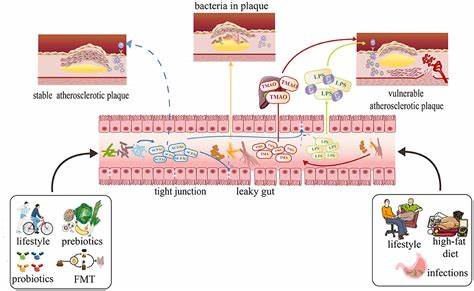
动脉粥样硬化作为全球首要的致死性疾病之一,长期以来被认为主要由胆固醇和脂肪沉积引发。然而,近年来西班牙科学家们的研究揭示,肠道中的某些细菌能够产生一种名为咪唑丙酸(imidazole propionate)的分子,直接导致动脉粥样硬化的发生。该发现不仅挑战了传统的致病理论,也为心血管疾病的诊断和治疗提供了全新的视角和方法。研究团队通过对数千名西班牙巴塞罗那银行员工进行了多年跟踪调查,结合先进的医学影像技术,发现了这一现象的科学依据。研究对象均为年龄在40至55岁之间的健康成年人,然而其中高达63%的志愿者通过CT和PET等成像手段显示存在动脉粥样硬化的早期迹象。更令人震惊的是,部分体内咪唑丙酸水平异常升高的志愿者显示出动脉内部出现炎症反应和脂肪斑块的快速增生。
此分子具有C6H8N2O2的化学结构,能够进入血液循环并与尚未成熟的白细胞相互作用,触发免疫系统的炎症机制,从而加速动脉壁脂肪沉积并促进斑块形成。通过在实验性小鼠体内直接注入咪唑丙酸,科学家成功诱导出动脉粥样硬化的病理表现,确切证明该分子具有独立致病能力。同时,研究还验证了在患有活动性动脉粥样硬化的患者中,这种分子的血液浓度显著偏高,表明其在临床病理状态中发挥着重要作用。过去的研究往往聚焦于降低胆固醇作为预防和治疗心血管疾病的主要手段,但这一新发现表明,除了胆固醇水平,炎症和免疫系统的异常激活同样是疾病发展的关键因素。该分子通过特定受体介导其致病作用,研究团队已经成功开发出一种新型抑制剂,可以有效阻断这一通路。在高胆固醇饮食背景下给药的小鼠实验显示,抑制剂能够完全阻止动脉粥样硬化的发展,显示出强大且具有临床转化潜力的疗效。
中国人饮食结构不断西化,导致心血管疾病发病率持续攀升,而本次发现对于制定更精准的预防策略和个性化治疗方案意义重大。研究还初步指出,某些肠道菌群如大肠埃希菌(Escherichia)、志贺氏菌(Shigella)和芽孢杆菌属(Eubacterium)在特定条件下可能成为咪唑丙酸的来源。由此引发的肠道微生态失衡,不仅关系到代谢健康,也成为心血管疾病潜在的触发因素。同时,生活方式及饮食习惯对肠道菌群的多样性和代谢产物产生有直接影响。数据显示,摄入富含蔬菜、水果、全谷物、鱼类、茶叶及低脂奶制品的人群血液中咪唑丙酸含量较低,进一步彰显健康饮食的重要性。心血管疾病每年夺去约1800万人生命,其发生和发展涉及多因素多机制交织。
此次对咪唑丙酸及其作用机制的阐明为未来提供了有力的科学依据,推动疾病早期检测和干预技术的发展,有望减少因传统风险因子检测失效而错过的隐匿病例。值得一提的是,这类由肠道细菌产生的小分子毒素在其他疾病领域同样引起广泛关注。比较典型的例子是大肠埃希菌分泌的colibactin毒素被认为与结直肠癌的发生密切相关。近年来,全球年轻人结直肠癌病例显著增加,其中潜在机制之一与肠道微生物相关毒素的暴露有关,提示微生物代谢产物与重大学疾患之间联系的普遍性和复杂性。除了临床诊断和治疗,相关研究也激发了生物技术和药物研发领域的创新动力。针对肠道微生物产生的有害分子及其受体的靶向药物有望成为未来心血管病防治的重要武器。
同时,基于肠道菌群调节的干预策略,例如益生菌、膳食纤维及有针对性的抗菌措施,也成为医学探索的新方向。在实际生活中,保持肠道微生态的平衡显得尤为重要。人们应更加注重合理饮食与健康生活习惯的养成,从根本上减少有害微生物及其代谢毒素的产生,从而降低心血管病的风险。结合运动、戒烟、减压等综合措施,形成科学、有效的预防体系,是未来动脉粥样硬化防控工作的关键所在。总之,肠道细菌产生的咪唑丙酸作为动脉粥样硬化新致病因子的发现,标志着心血管疾病研究进入一个新阶段。这促使医学界重新审视疾病复杂机制,拓展治疗视野,使临床医疗更具针对性和个体化。
未来通过多学科合作,整合基础研究、临床应用及公共健康策略,有望在减轻动脉粥样硬化负担、提升患者生活质量方面取得重大突破。